MYOSINE
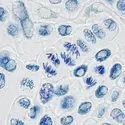
Protéine de masse moléculaire élevée (460 000), la myosine constitue, dans la cellule musculaire striée, les myofilaments épais des disques sombres des myofibrilles (structures intracytoplasmiques contractiles). De forme allongée (160 nm), la macromolécule de myosine est formée de deux longues chaînes torsadées ensemble pour constituer une sorte de « manche » dont l'une des deux extrémités bifurque pour donner naissance à deux « têtes » globulaires : l'ensemble a donc l'aspect de la lettre Y. Du fait de cette asymétrie moléculaire, les faisceaux de myosine qui constituent les myofilaments orientent les têtes à chacune de leurs extrémités, d'où l'aspect bipolaire d'une telle structure, bien visible en microscopie électronique.
Ce sont ces extrémités, regroupant les excroissances « globulaires » des molécules de myosine, qui sont en mesure de tirer de l'énergie des molécules d'ATP qu'elles hydrolysent (activité ATPasique), d'où la possibilité de déclencher la contraction. Elles ont d'autre part une « flexibilité » qui rend compte de leur liaison mécanique réversible avec les protéines contractiles voisines (actine, tropomine et tropomyosine) lors du raccourcissement des myofibrilles qui matérialise cette contraction à l'échelle cellulaire. Les points de flexibilité coïncident avec des zones fragiles, sur lesquelles agissent les protéases qui sont les enzymes hydrolysant les protéines : la papaïne qu'on trouve dans certains sucs végétaux (ananas) et la trypsine du suc pancréatique.
La première détache les extrémités globulaires (fraction HMM-S1 de masse 115 000 daltons) où l'on a pu détecter la présence de chaînes polypeptidiques accessoires plus courtes et dites légères ; le nombre et la nature de ces chaînes varient beaucoup selon le type de muscle dont elles proviennent (masse moléculaire variant de 15 000 à 25 000 selon les cas). La seconde enzyme s'attaque à l'emplacement de la bifurcation qui porte les deux têtes globulaires. On obtient de ce fait deux tronçons dits méromyosines : méromyosine légère (LMM masse 140 000 daltons) qui correspond au « manche » de la macromolécule, et méromyosine lourde (HMM, 340 000 daltons), dont les têtes globulaires peuvent être détachées en faisant agir la papaïne.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Didier LAVERGNE : docteur en médecine
Classification
Autres références
-
MITOSE
- Écrit par Nina FAVARD
- 6 522 mots
- 5 médias
Les mécanismes de la cytodiérèse des cellules animales sont basés sur des interactions actine- myosine. -
ACTINE
- Écrit par Gérard BISERTE et Daniel TETAERT
- 692 mots
L'actine est une protéine « universelle » qui a été identifiée dans le cytoplasme de nombreuses cellules eucaryotes différentes, aussi bien animales que végétales (par exemple, l'actine identifiée dans le cytoplasme de l'algue verte Nitella). L'actine a été également...
-
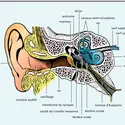
AUDITION - Acoustique physiologique
- Écrit par Pierre BONFILS , Yves GALIFRET et Didier LAVERGNE
- 14 814 mots
- 17 médias
...pivoter à partir de sa base étroite qui ne comprend plus qu'une vingtaine de filaments d'actine. Quant à la pièce mobile, elle pourrait être constituée d'une myosine de type IB qui est capable de « grimper » le long d'un filament d'actine et possède trois sites putatifs de liaison avec la calmoduline nécessaire... -
BIOPHYSIQUE
- Écrit par Claude Michel GARY-BOBO
- 6 414 mots
...contraction musculaire et plus généralement de la motilité cellulaire ; celle-ci est fondée sur l'association de deux protéines, l' actine et la myosine, que l'on retrouve dans toutes les cellules douées de motilité, mais qui est particulièrement développée dans les cellules musculaires. La myosine... - Afficher les 8 références