NITRILES
Article modifié le
Hydrogénation
L' hydrogénation totale de la fonction nitrile en amine primaire est réalisée soit par voie catalytique, en présence de Fe/Ni ou de Cr/Ni :
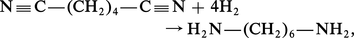

Addition des hydracides
L'addition d'acide chlorhydrique sec conduit à un produit cristallisé qui possède un chlore très mobile, semblable à celui des chlorures d'acides.
Hydrolyse
L' hydrolyse des nitriles est réalisée par chauffage avec un acide ou une base forts. Elle fait intervenir successivement l'hydratation de la fonction en amide puis l'hydrolyse de ce dernier en acide. L'arrêt de la réaction au stade amide n'a lieu que si un empêchement stérique ralentit son hydrolyse. L'eau oxygénée s'additionne en formant un peroxyde de nitrile, oxydant puissant qui transforme les oléfines en époxydes et les amines tertiaires en oxydes d'amines.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Média
Autres références
-
AMIDES
- Écrit par Jacques METZGER
- 1 922 mots
- 3 médias
L' hydratation des nitriles, en catalyse acide ou basique, conduit aux amides primaires, mais la réaction est difficile à contrôler car ces derniers, dans ces conditions, s'hydrolysent en sel d'ammonium de l'acide. On peut toutefois contrôler cette hydratation en employant l'eau oxygénée qui forme un... -
AMINES
- Écrit par Jacques METZGER
- 3 235 mots
- 4 médias
Ces dernières sont également obtenues par l'hydrogénation catalytique desnitriles sur catalyseur de nickel à 100 0C. On les prépare enfin par réduction des imines : ces dernières résultant de l'action de l'ammoniac sur un dérivé carbonylé, ces deux composés sont soumis à l'hydrogénation :... -
CASSINI-HUYGENS (MISSION)
- Écrit par Athéna COUSTENIS
- 4 465 mots
- 9 médias
...atmosphère et produisent des composés organiques complexes (essentiellement des hydrocarbures comme l’éthane, l’acétylène et le propane, ou des nitriles comme l’acide cyanhydrique) qui se diffusent à travers l’atmosphère, se condensent et viennent se déposer à la surface de ce satellite. Les mesures... -
CYANURE D'HYDROGÈNE
- Écrit par Encyclopædia Universalis
- 331 mots
Également appelé formonitrile, le cyanure d'hydrogène H—C≡N est un liquide incolore, très mobile, de forte odeur d'amandes amères, fortement toxique et miscible à l'eau en toutes proportions : ses solutions sont connues sous le nom d'acide cyanhydrique ou acide prussique (nom provenant...
- Afficher les 8 références
Voir aussi