OXYGÈNE
Article modifié le
Chimie de l'oxygène
L'oxygène est, sans aucun doute, l'un des éléments qui possèdent, tant dans le domaine de la chimie minérale que dans celui de la chimie organique, le plus grand nombre de composés dont plusieurs, en raison de leur spécificité ou de leur importance, sont décrits dans des rubriques particulières (eau, composés oxygénés de la chimie organique, etc.). L'action de l'oxygène a d'ailleurs donné naissance à des concepts fondamentaux en chimie tels que ceux d'oxydoréduction et de corrosion. On ne décrira ici que les propriétés générales des composés oxygénés en mentionnant certains d'entre eux qui font l'objet d'un intérêt scientifique ou industriel récent.
Réactions spécifiques du dioxygène gazeux
Dans le tableau périodique, l'oxygène occupe la tête de la colonne VI des éléments dits chalcogènes (générateurs de métaux). À ce titre, il présente, dans la majorité de ses combinaisons, le degré d'oxydation — 2, notion qui caractérise un gain de deux électrons et qui a été étendue à de nombreuses réactions. Lorsque les réactions ont lieu avec un fort dégagement de chaleur, on les qualifie de combustions, qui peuvent être vives (apparition d'une flamme) ou lentes. Rappelons quelques réactions parmi les plus spectaculaires :
– Les métaux alcalins et alcalino-terreux peuvent s'enflammer spontanément (surtout les alcalins) et fournissent des oxydes très stables et même réfractaires (MgO, CaO...).
– La plupart des métaux brûlent avec vivacité, et cela d'autant plus qu'ils sont finement divisés (Al, Cr, Mn, Fe, Co, Ni). Les métaux nobles ne sont, en revanche, pas attaqués directement, mais l'on parvient indirectement à leurs oxydes.
À l'exception des halogènes, les non-métaux brûlent dans le dioxygène ; le bore donne B2O5, le soufre SO2, le phosphore P2O5 (inflammation spontanée), le carbone CO qui s'oxyde en CO2, le silicium SiO2. Seul le diazote exige une température élevée (2 000 0C) pour se combiner au dioxygène ; la réaction est d'ailleurs endothermique :

La réaction avec le dihydrogène :

À la température ambiante, l'oxydation est favorisée par la présence de certains catalyseurs ou de vapeur d'eau : c'est le cas du fer attaqué en profondeur par la rouille, contrairement à l'aluminium où la couche d'oxyde Al2O3 bloque la corrosion.
En résumé, tous les éléments de la classification, à l'exception des trois premiers gaz rares (He, Ne et Ar), se combinent à l'oxygène, et cela directement, excepté les halogènes, les métaux nobles, le krypton et le xénon.
Avec les composés, le dioxygène agit par addition (CO → CO2, NO → NO2, SO2 → SO3, FeO → Fe2O3) ou par substitution si la chaleur de formation du composé formé est supérieure à celle du produit décomposé.
En chimie organique, on procède à de nombreuses oxydations (cf. supra) ménagées ou incomplètes en présence de catalyseurs. On substitue d'ailleurs au dioxygène d'autres oxydants (ozone, eau oxygénée, permanganate, chlorate, etc.).
Certains composés, dits antioxygènes (Moureu et Dufraisse), agissent comme des inhibiteurs, tel l'[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Robert CREUSE : chef du service information et gestion, direction des centres de recherche et de développement de la société Air liquide
- René NOTO : médecin-colonel, anesthésiste-réanimateur, chargé de l'enseignement de la médecine d'urgence et de la médecine de catastrophe au service de santé des armées
Classification
Médias
Autres références
-
AÉROBIOSE & ANAÉROBIOSE
- Écrit par Claude LIORET
- 2 736 mots
- 1 média
-
AÉRONOMIE
- Écrit par Gaston KOCKARTS
- 4 158 mots
- 11 médias
...reproductibles. De nouveaux constituants atmosphériques apparaissent et sont susceptibles d'influencer à leur tour la structure de l'atmosphère. En partant de l' oxygène moléculaire (O2), dont la première limite de dissociation est à 242,4 nm, le rayonnement solaire produit des atomes d'oxygène suivant le mécanisme... -
AIR
- Écrit par Jean PERROTEY
- 2 155 mots
- 2 médias
...vie. Le constituant actif est assimilé au gaz obtenu par calcination du salpêtre, ou « nitre », d'où le nom d'« esprit nitro-aérien » alors donné à l' oxygène. Un siècle plus tard, la nature de l'air est vraiment élucidée par Lavoisier. L'expérience par laquelle il établit la composition de l'air est,... -
ANÉMIES
- Écrit par Bruno VARET
- 3 094 mots
- 5 médias
...d'hémoglobine. Les constituants des globules rouges autres que l'hémoglobine semblent n'avoir pour fonction que de protéger l'hémoglobine de l'oxydation. La fonction essentielle de l'hémoglobine est le transport de l'oxygène. Il est donc logique que la baisse de la pression partielle en oxygène au niveau... - Afficher les 69 références
Voir aussi
- OZONE
- PEROXYDES
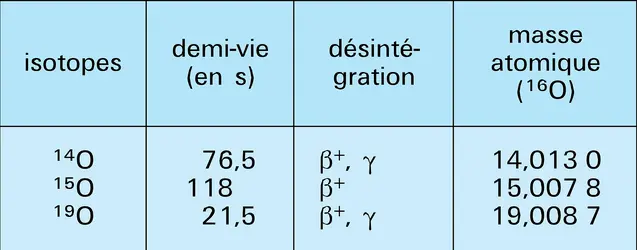
- ISOTOPES
- PARAMAGNÉTISME
- ÉPURATION DES EAUX
- RÉANIMATION
- RADIOÉLÉMENTS ou RADIONUCLÉIDES ou ISOTOPES RADIOACTIFS
- CAISSON HYPERBARE
- DÉPOLLUTION
- GAZODUC
- RESPIRATION ARTIFICIELLE ou VENTILATION ARTIFICIELLE
- CHIMIQUES INDUSTRIES
- OXYACÉTYLÉNIQUE CHALUMEAU
- DÉSINFECTANTS
- COVALENTE LIAISON
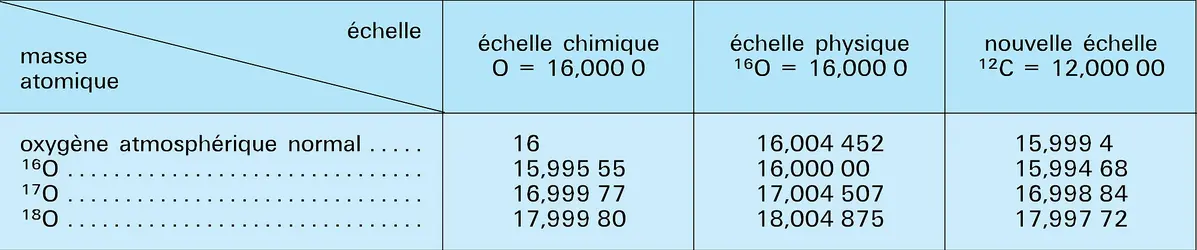
- MASSE ATOMIQUE
- EAU OXYGÉNÉE (peroxyde d'hydrogène)
- OZONIDES
- SUPEROXYDES
- ORBITALES MOLÉCULAIRES
- DOUBLE LIAISON ou LIAISON ÉTHYLÉNIQUE
- DEGRÉ D'OXYDATION
- OXYDATION
- OXYDANTS
- OXYGÈNE ATMOSPHÉRIQUE
- GAZEUX ÉTAT
- SINGULET ÉTAT
- ÉLECTRONIQUE STRUCTURE
- OXHYDRIQUE CHALUMEAU
- INSUFFISANCE RESPIRATOIRE
- CONFIGURATION ÉLECTRONIQUE
- SOINS INTENSIFS
- OXYGÉNOTHÉRAPIE
- RESPIRATOIRE PATHOLOGIE
- RESPIRATION
- RESPIRATION ASSISTÉE ou ASSISTANCE RESPIRATOIRE
- DÉTRESSE RESPIRATOIRE AIGUË
- OXYDES
- FLUORURES
- IONIQUE LIAISON
- VENTILATION PULMONAIRE
- URGENCES, médecine
- OXYGÈNE LIQUIDE