OZONE ATMOSPHÉRIQUE
Article modifié le
L'ozone troposphérique
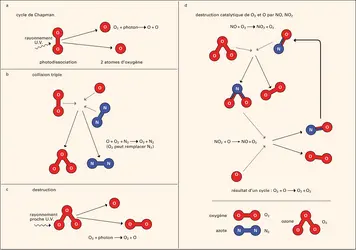
L'ozone contenu dans la stratosphère protège la vie parce que le lien assez lâche entre le troisième atome d'oxygène et les deux autres permet l'absorption des photons de l'U.V. proche lorsqu'ils rompent ce lien. Mais, pour la même raison, l'ozone se combine facilement avec d'autres molécules ou atomes. Cette réactivité correspond à une toxicité, ce qui peut être utile. Pour tuer les microbes, pour purifier l'eau des piscines, on emploie parfois l'ozone à la place du chlore. Dans la troposphère, atmosphère où nous vivons, l'ozone, souvent directement associé à la pollution, est un gaz dangereux pour la santé des êtres vivants et des plantes.
D'où vient cet ozone ? On a longtemps cru qu'il venait surtout de la stratosphère. Mais les travaux de Crutzen des années 1970 ont montré que les différents cycles de réactions photochimiques, dont certains opèrent même dans l'air « propre », produisent de l'ozone dans la troposphère, et que ces cycles sont particulièrement sensibles aux perturbations des cycles de l'azote dues aux activités humaines. Même dans un milieu parfaitement « naturel », notre atmosphère d'azote et d'oxygène a tout ce qu'il faut pour fabriquer des oxydes d'azote : les éclairs, les incendies de forêts ou de prairies, les microbes qui interviennent dans les processus de nitrification et de dénitrification des sols, etc. À ces sources naturelles, il faut ajouter celles qui sont liées à l'activité humaine – feux de brousse, incendies liés à la déforestation, combustion de carburants fossiles, modification de la chimie des sols par les engrais artificiels. Il faut en outre tenir compte de nombreuses autres espèces chimiques de la troposphère. La production d'ozone dépend en partie de la concentration des oxydes d'azote, mais celle-ci dépend bien sûr de la compétition entre les processus de formation et de destruction, ces derniers dépendant à leur tour d'autres espèces, avec une complexité encore plus grande que dans la stratosphère.
Parmi ces gaz dont l'abondance affecte celle de l'ozone troposphérique, il y a notamment le méthane, gaz (d'ailleurs à fort effet de serre) produit par des bactéries dans des milieux privés d'oxygène – marécages, rizières, estomacs des ruminants, etc. – ou perdu dans l'atmosphère par l'exploitation des puits de pétrole. L'autre gaz important est le monoxyde de carbone (CO) provenant de la combustion incomplète de la matière carbonée (biomasse, carburants fossiles, méthane et autres hydrocarbures dans l'air, etc.). Aujourd'hui, à l'échelle planétaire, au moins 60 p. 100 des émissions des gaz CH4, CO et NOx sont anthropiques. Il faut aussi tenir compte de divers composés organiques volatils (COV), en majorité naturels (terpènes émis par la végétation), mais aussi – pour 10 p. 100 environ – anthropiques (hydrocarbures, surtout aromatiques comme le benzène). Le radical hydroxyle OH constitue une autre espèce clé. Si l'atmosphère contient assez d'oxydes d'azote (plus de 0,01 à 0,02 ppb), la réaction
(11) OH + CO → H + CO2
conduit, via un cycle réactionnel, à une production nette d'ozone :
(12) CO + 2 O2 → CO2 + O3
avec NO et NO2 agissant comme catalyseurs. Si la quantité des oxydes d'azote est trop faible, on a un cycle qui commence avec la réaction (11) et qui a comme effet net :
(13) CO + O3 → CO2 + O2.
D'autres cycles de ce type s'appliquent à la réaction entre le méthane et le radical hydroxyle OH.
Dans l'atmosphère polluée, avec une forte présence d'oxydes d'azote, de CO et de COV, les processus sont encore plus compliqués. S'il s'agit d'une région fortement ensoleillée, la concentration d'ozone peut atteindre[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Robert KANDEL : directeur de recherche honoraire du C.N.R.S., laboratoire de météorologie dynamique, École polytechnique, Palaiseau
Classification
Médias
Autres références
-
TROU DANS LA COUCHE D'OZONE
- Écrit par Florence DANIEL
- 316 mots
- 1 média
L'ozone (O3) situé dans la stratosphère joue un rôle protecteur en absorbant les rayons ultraviolets. Une diminution de sa teneur a pour conséquence d'augmenter le bombardement de la surface terrestre par les U.V., ce qui a des effets néfastes sur tous les êtres vivants.
En...
-
AÉRONOMIE
- Écrit par Gaston KOCKARTS
- 4 158 mots
- 11 médias
...pour assurer la conservation de l'énergie :Dans la stratosphère, il existe une autre réaction très efficace : donnant lieu à la formation de l' ozone (O3). Cependant, les molécules d'ozone peuvent être détruites par la réaction :
donnant lieu à la formation de l' ozone (O3). Cependant, les molécules d'ozone peuvent être détruites par la réaction : ou peuvent être photodissociées suivant le processus :...
ou peuvent être photodissociées suivant le processus :...
-
AIR
- Écrit par Jean PERROTEY
- 2 155 mots
- 2 médias
...moins en partie, régulée par sa dissolution dans l'eau et par la présence d'énormes masses de calcaires à la surface du globe. Le protoxyde d'azote et l'ozone sont synthétisés dans la haute atmosphère, à une altitude supérieure à 25 kilomètres. L'énergie du rayonnement ultraviolet solaire est en grande... -
ANTARCTIQUE
- Écrit par Pierre CARRIÈRE , Edmond JOUVE , Jean JOUZEL , Gérard JUGIE et Claude LORIUS
- 16 485 mots
- 24 médias
Formé de trois atomes d'oxygène, l'ozone (O3) est un constituant présent dans l'atmosphère en très faible quantité, équivalente à une épaisseur de quelques millimètres dont environ 90 p. 100 entre 20 et 50 kilomètres d'altitude. Son rôle est cependant essentiel, car il absorbe très efficacement... -
ATMOSPHÈRE - La couche atmosphérique terrestre
- Écrit par Jean-Pierre CHALON
- 7 817 mots
- 7 médias
...0,93 p. 100 pour l’argon) conservent une proportion quasiment constante jusqu’à une altitude proche de 80 à 100 kilomètres. Les proportions moyennes en ozone font exception à cette règle : alors qu’elles ne dépassent pas 5 × 10-6 p. 100 (soit 50 molécules d’ozone par milliard de molécules d’air)... - Afficher les 29 références
Voir aussi
- MONOXYDE D'AZOTE
- RAYONNEMENT SOLAIRE
- TROPOSPHÈRE & TROPOPAUSE
- STRATOSPHÈRE & STRATOPAUSE
- PINATUBO, volcan
- ABSORPTION ATMOSPHÉRIQUE
- DIOXYDE D'AZOTE
- CHAPMAN SYDNEY (1888-1970)
- OXYDES D'AZOTE
- VOLCANISME ACTUEL
- CHANGEMENT CLIMATIQUE
- CANICULE
- MONTRÉAL PROTOCOLE DE (1987)
- RÉCHAUFFEMENT CLIMATIQUE
- ATMOSPHÈRE, chimie
- ENVIRONNEMENT, droit et politique
- AÉROSOLS
- EFFET DE SERRE
- ARCTIQUE RÉGION
- ANTHROPISATION
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- PHOTODISSOCIATION
- CHLOROFLUOROCARBURES (CFC)
- CARBONIQUE GAZ ou DIOXYDE DE CARBONE
- POLLUTION ATMOSPHÉRIQUE ou POLLUTION DE L'AIR