PARASEXUALITÉ
Article modifié le
L'existence de phénomènes sexuels est la règle chez les Eucaryotes, c'est-à-dire chez l'ensemble des êtres vivants formés d'une cellule ou d'un grand nombre de cellules. Chacune d'elles renferme, au sein de son cytoplasme, un noyau différencié. Leur cycle reproductif biologique comporte l'alternance d'une phase haploïde, pendant laquelle les noyaux ne renferment qu'un exemplaire de chaque chromosome et donc de chaque gène, et d'une phase diploïde où deux exemplaires de chaque chromosome sont présents. Le passage de la phase haploïde à la phase diploïde résulte de la fusion de deux cellules sexuelles haploïdes, complémentaires quoique différentes (cf. gamètes), qui mettent en commun leur matériel génétique ; après quoi, le retour à l'état haploïde sera réalisé, tôt ou tard, par la méiose. Les ségrégations indépendantes des chromosomes non homologues, d'une part, les crossing over entre chromosomes homologues, d'autre part, qui se produiront à la méiose, permettent la redistribution des gènes préalablement associés dans une même cellule. Ces phénomènes aboutissent, à chaque génération, à la production d'une gamme très étendue de combinaisons de gènes, de génotypes haploïdes puis diploïdes distincts. En amplifiant d'une manière extraordinaire l'effet des mutations, ils sont une source de variabilité génétique. Ainsi, le jeu combiné des fusions cellulaires à la fécondation et de la mécanique chromosomique à la méiose assure un brassage régulier et efficace de l'information génétique et réalise l'intégration des individus qui participent à des échanges sexuels en un ensemble dont le niveau d'organisation est plus stable que celui de l'individu ; c'est celui de la population et de l'espèce. La faculté de réaliser des échanges, des recombinaisons génétiques, est donc une propriété absolument fondamentale et nécessaire du matériel génétique des êtres vivants.
Contrairement à celui des Eucaryotes, le cycle de reproduction des êtres vivants dont le matériel génétique filamenteux n'est pas enfermé dans un noyau – ce sont les Protocaryotes – ne comporte pas d'alternance régulière de phases haploïde et diploïde. On a cependant découvert chez ces organismes différents mécanismes qui assurent le transfert d'information génétique d'un individu à l'autre. C'est à propos de ces mécanismes qui, en permettant les recombinaisons génétiques, remplissent le rôle essentiel de l'ensemble fusion cellulaire-méiose chez les Eucaryotes, que l'on parle de parasexualité.
Les contaminations génétiques
Cas des virus
Le matériel génétique des virus, qu'il s'agisse d'acide ribonucléique (ARN) ou désoxyribonucléique (ADN), est, comme celui de tous les organismes, susceptible de muter. La variabilité génétique peut affecter différents caractères viraux, la thermosensibilité par exemple, c'est-à-dire l'intervalle de températures à l'intérieur duquel un virus peut se multiplier, ou bien le spectre d'hôtes, c'est-à-dire le catalogue de cellules, de tissus ou d'organismes que le virus est capable d'infecter. Ainsi, la souche « sauvage » du bactériophage T2 se multiplie dans une souche A du colibacille (Escherichia coli). Elle donne sur un tapis bactérien A des plages de lyse formées d'un petit centre clair entouré d'un halo. Cette même souche « sauvage » ne se multiplie pas et ne donne pas de plages de lyse sur un tapis de bactéries d'une autre souche du colibacille, la souche B. Certains mutants de T2 infectent également les bactéries des souches A et B. On représente par le symbole h la mutation responsable de l'élargissement du spectre d'hôtes ici constatée. D'autres mutants déterminent sur bactéries A de grandes plages sans halo. On représente par le symbole r la mutation qui modifie l'allure de la plage de lyse. Les souches mutantes r ne forment pas de plage sur bactéries B.
La parasexualité des virus est liée au fait qu'une même cellule hôte peut être infectée par plusieurs sortes de particules virales (virions). Ainsi, l'infection simultanée de colibacilles par des phages des souches r et h permet l'obtention d'une récolte virale qui contient non pas deux, mais quatre génotypes viraux. L'un des types est incapable de se multiplier dans les bactéries B et donne, sur tapis bactérien A, de grandes plages dépourvues de halo. Un second type se multiplie également dans les bactéries A et B sur lesquelles apparaissent de petites plages à halo. Ces deux premiers types sont respectivement identiques aux deux souches r et h utilisées pour réaliser l'infection mixte. Un troisième type viral est capable d'infecter les bactéries A et B sur lesquelles il forme de grandes plages sans halo. Les deux mutations r et h sont donc l'une et l'autre présentes dans ce nouveau génotype. Enfin, le dernier type ne se multiplie que dans les bactéries A sur lesquelles il forme de petites plages à halo. Identique à la souche « sauvage » de T2 ainsi reconstituée, il ne contient ni la mutation r ni la mutation h.
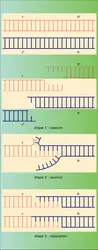
L'infection mixte est donc l'équivalent d'un croisement. La présence de nouveaux génotypes, dans les récoltes virales obtenues à la suite d'une infection mixte, est la manifestation d'interactions suivies, de recombinaisons génétiques qui se produisent entre les molécules d'acide nucléique viral au cours du cycle reproductif intracellulaire. Les trois étapes : cassure, réunion, réparation d'une recombinaison, sont illustrées ici par la figure 1. Le génome des virus est souvent constitué d'une unique molécule d'acide nucléique. Dans la cellule infectée, les molécules sont reproduites, mais également fragmentées sous l'action de nucléases (1re étape). La reconnaissance des fragments complémentaires et leur réunion sont, en premier lieu, fondées sur la complémentarité des séquences des bases des deux chaînes polynucléotiques du génome viral (2e étape). Ensuite, l'action conjuguée de différentes enzymes (nucléases, polymérases, ligases) rétablit la continuité des deux chaînes polynucléotidiques (3e étape) et l'intégrité de la molécule. La réunion de fragments provenant de deux molécules, d'origine différente, peut ainsi donner un génome complet recombiné.
Cas des bactéries
Les mécanismes de parasexualité actuellement connus chez les bactéries ne consistent jamais en la fusion de deux corps bactériens. Ils comportent toujours le transfert d'acide désoxyribonucléique d'une bactérie donneuse à une bactérie receveuse. Les deux partenaires jouent donc des rôles dissymétriques. La parasexualité chez les bactéries est donc le transfert d'un fragment d'ADN d'une bactérie à une autre, éventuellement suivi d'une recombinaison qui substitue tout ou partie du fragment d'ADN exogène à l'ADN homologue endogène.
Les modalités du transfert sont diverses. La situation la plus primitive est la transformation où le transfert s'effectue sous forme d'ADN nu. Lorsque c'est un virus qui se charge du transport, on parle de transduction. Dans ces deux cas, l'échange ne nécessite aucun contact direct entre bactéries donneuse et receveuse. En revanche, dans la conjugaison, le transfert se produit à la faveur d'un véritable appariement entre deux bactéries de types sexuels complémentaires.
La transformation bactérienne
Si des bactéries sensibles à la streptomycine sont placées dans une solution d'ADN purifié extrait d'une souche de bactéries appartenant à la même espèce, mais résistant à cet antibiotique, on voit apparaître, parmi les bactéries sensibles traitées, des bactéries transformées, recombinées, résistant à la streptomycine. Toutes les espèces bactériennes ne sont pas transformables ; mais lorsque l'espèce est transformable, l'expérience ne réussit que si les bactéries se trouvent dans un état physiologique particulier, dit de compétence, qui permet la fixation et l'absorption de l'ADN transformant. Il est également nécessaire que l'ADN ne soit pas trop dégradé et que sa masse moléculaire soit au moins de l'ordre du million de daltons. Dans les meilleures conditions expérimentales, l'efficacité demeure faible : la fréquence, parmi les bactéries traitées, des bactéries transformées pour un caractère, la résistance ou la sensibilité à un antibiotique par exemple, ne dépasse que rarement 1 p. 100. Elle est souvent beaucoup plus faible.
La transduction
Une petite fraction des particules virales produites par une bactérie, à la suite de leur l'infection par certains bactériophages, est formée d'une capside de protéines virales entourant un fragment d'ADN bactérien. Autrement dit, chez cette bactérie infectée, l'édification des virions, peut, accidentellement, s'effectuer autour de morceaux d'ADN bactérien au lieu d'une molécule d'ADN phagique. Ces particules mixtes dites transductrices, peuvent, tout comme les virions normaux, se fixer sur une bactérie sensible et y injecter l'ADN qu'elles contiennent. Elles permettent donc le transfert d'un morceau d'ADN bactérien d'une bactérie à une autre et lui assurent une protection qui fait défaut à l'ADN transformant dont il était question dans le cas, précédemment examiné, du transfert. La taille du fragment transféré, sensiblement égale à celle de l'ADN viral qu'il remplace, dépend donc de l'espèce du phage transducteur. Pour les petits phages, elle représente environ 1 p. 100 du génome bactérien, c'est-à-dire une longueur comparable à celle des molécules d'ADN transformant. Les plus gros phages peuvent transporter jusqu'au dixième du génome d'une bactérie. La transduction réalise la même situation que la transformation. Pour être héréditairement transmis, l'ADN introduit doit être intégré dans le chromosome de la bactérie réceptrice. La fréquence des particules transductrices dans une récolte virale, bien que variable selon le phage et la région du chromosome bactérien considéré, est toujours de l'ordre du millionième. La transduction n'est donc pas un mécanisme très efficace d'échange d'informations génétiques.
La conjugaison
Le facteur sexuel F d'Escherichia coli est un épisome dont la taille est d'environ 1 p. 100 de celle du chromosome et dont la propriété essentielle est de rendre « fertiles » les bactéries qui le portent. Cette fertilité se manifeste de différentes manières suivant que le facteur sexuel est autonome (bactérie F+) ou intégré dans le chromosome (bactérie Hfr). Les bactéries F+ ou Hfr sont dites donatrices ou mâles, alors que les bactéries dépourvues de facteur sexuel (F—) sont dites réceptrices ou femelles.
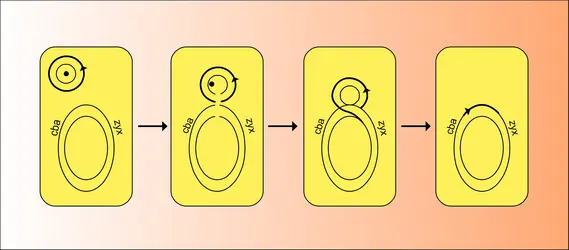
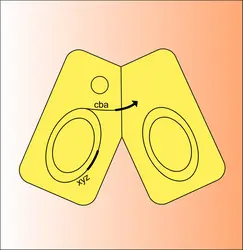
La découverte du facteur F est liée à l'étude de la recombinaison génétique chez Escherichia coli K12. En 1946, Lederberg et Tatum montraient que, en mélangeant deux cultures bactériennes X (abc DEF) et Y (ABC def) respectivement polyauxotrophes, c'est-à-dire exigeantes en produits variés (abc pour X, et def pour Y), on récupérait des bactéries prototrophes Z (ABCDEF) ne nécessitant aucun de ces produits. Les bactéries Z, ne pouvant être des mutants réverses de X ou Y en raison du changement simultané de plusieurs caractères, sont des « recombinants » entre X et Y. Rapidement, on s'aperçut que les bactéries X et Y ne jouaient pas un rôle identique. La survie d'une des deux bactéries X ou Y est nécessaire à la production de recombinants, alors que l'on peut tuer l'autre avant ou pendant le croisement sans diminuer le nombre de recombinants qui apparaissent. La bactérie Y, par exemple, dont la survie est absolument nécessaire, est la bactérie réceptrice : en elle a lieu le processus de recombinaison au niveau moléculaire. La bactérie X est alors la bactérie donatrice (F+). À partir des bactéries F+, on a pu isoler des variants qui ne donnent plus de recombinants avec une souche F—. Par ailleurs, on peut classer les souches d'Escherichia coli en deux types : les souches qui, croisées entre elles, ne donnent jamais de recombinants (souche F—) et les souches qui donnent des recombinants avec n'importe quelle autre souche (souche fertile F+).
Les types sexuels F+ et F—
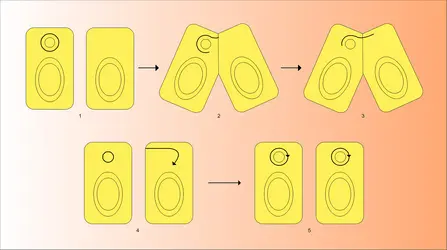
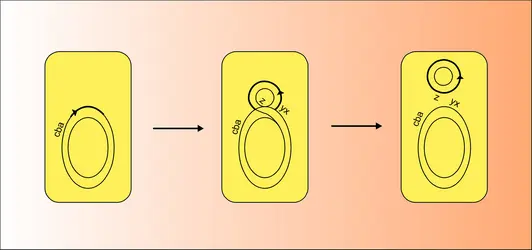
Le caractère F+ ou F— qui donne aux bactéries le phénotype donneur ou receveur apparaissait donc jusqu'en 1953 comme un caractère génétique classique, déterminé par le chromosome et qui pouvait muter par exemple de F+ vers F—. Cependant, certaines propriétés très particulières du caractère F+ ont montré qu'il n'était pas codé par des gènes chromosomiques. Lors d'un croisement entre une souche F+ et une souche F—, on obtenait de l'ordre de 10—6 à 10—7 recombinant pour les caractères chromosomiques ; en revanche, la majorité des bactéries réceptrices sont converties en bactéries F+. C'était la première preuve d'indépendance du facteur F par rapport au chromosome. Cette indépendance devait se confirmer par le fait que, lorsqu'on mélange un nombre connu de bactéries donatrices avec un nombre plus grand de bactéries F—, ces dernières sont converties en bactéries F+ à une vitesse supérieure à celle de la multiplication bactérienne. Cela signifie que le facteur F se réplique de manière autonome et à une vitesse qui peut être supérieure à celle du chromosome, ce qui lui permet d'envahir par transfert toute une culture : on dit qu'il est « infectieux » (fig. 2). Enfin, le facteur F peut être spontanément perdu par une souche, à un taux qui est en général beaucoup plus grand que le taux de mutation. F est donc un élément indépendant du chromosome, capable de se répliquer à une vitesse propre et de se transférer de bactérie à bactérie par conjugaison à haute fréquence. C'est un plasmide autotransférable.
Les mutants Hfr
À partir de bactéries F+, Cavalli-Sforza et Hayes ont isolé des mutants qui produisaient mille fois plus de recombinants lorsqu'on les croisait avec des bactéries F—. Ces mutants se comportaient comme des « supermâles » : on les a appelés souches Hfr (haute fréquence de recombinaison). En plus du problème de la fréquence des recombinants, les croisements Hfr × F— présentaient essentiellement deux caractères qui les distinguaient des croisements F+ × F—. Les croisements F+ × F— conduisent à un nombre faible mais constant de recombinants Z (ABCDEF), quel que soit le caractère sélectionné. Cela montre donc que les bactéries donatrices F+ peuvent transférer n'importe quel segment de leur chromosome avec une égale fréquence (fig. 3). Au contraire, dans un croisement Hfr ×F—, le nombre de recombinants formés est très inégal suivant le caractère sélectionné. Par ailleurs, sauf cas exceptionnel, les bactéries réceptrices ne sont pas transformées en bactéries F+ dans un croisement Hfr × F—. Ces propriétés des donneurs Hfr ont suggéré que, dans ces bactéries, le facteur sexuel F existe sous un état différent de celui sous lequel il existe dans des bactéries F+. Il a été démontré par la suite que ce second état du facteur F est l'état intégré au chromosome bactérien où l'ADN de F est en continuité avec l'ADN de la cellule hôte. Nous avons déjà signalé qu'on a donné le nom d' épisome à de tels éléments génétiques capables d'exister sous deux états, libre (plasmide) ou intégré (épisome) au chromosome bactérien. Cette généralisation, principalement due à Jacob et Wollman, est née de l'étude du facteur F mais aussi des bactériophages tempérés et des facteurs colicinogènes.
Équilibre réplicatif et notion de réplicon
Jacob, Brenner et Cuzin ont proposé d'appeler « réplicon » les structures génétiques dont la réplication autonome est indépendante de celle du chromosome. Un réplicon est donc une unité de réplication. Dans cette hypothèse, que des travaux ultérieurs ont partiellement confirmée, un réplicon a au moins deux types de fonctions et comprend deux sortes de matériel génétique au sens fonctionnel.
Le premier type comporte les fonctions obligatoires intervenant spécifiquement dans la réplication et permettant à la molécule d'ADN qui les porte de se répliquer avec une vitesse et une régulation caractéristiques de ce réplicon. Les déterminants génétiques impliqués dans cette fonction seraient au moins deux. Il existerait un gène de structure codant pour la synthèse d'une protéine dite initiatrice qui agirait sur un second gène, le réplicateur, « véritable promoteur de la réplication ». Lorsque la protéine initiatrice agit sur le réplicateur, la réplication est amorcée et se poursuit tout le long de la molécule d'ADN adjacente au réplicateur (position cis). Ces deux gènes sont absolument spécifiques et l'initiateur produit par un réplicon donné, par exemple un phage, reconnaît le réplicateur de ce phage, mais pas le réplicateur du chromosome bactérien ou d'un autre type de phage.
Le second type de fonction est variable et caractérise le type de matériel génétique que l'on étudie : le facteur F porte des gènes qui permettent un transfert de matériel génétique ; les facteurs de résistance codent pour des enzymes qui détruisent certains antibiotiques ; le chromosome bactérien contient toute l'information nécessaire à la multiplication de la bactérie. Ces gènes se répliquent à la vitesse du réplicon qui les porte.
On sait actuellement que le facteur F se multiplie indépendamment du chromosome mais en accord avec lui de façon à conserver le rapport de un épisome par chromosome. Cependant, il peut se produire des cas où cet équilibre est rompu ; par exemple, si des bactéries F+ sont mises en contact avec des bactéries F—, le facteur F envahit la culture par le biais du transfert. Par ailleurs, certaines bactéries peuvent perdre le facteur F et deviennent F—. La fréquence de cette perte est de l'ordre de 10—2 à 10—4 selon les souches ; elle peut être accrue si on traite les bactéries par des colorants comme l'acridine orange. Notons que la transition spontanée du caractère F+ vers F— est possible alors que le passage de l'état F— vers l'état F+ nécessite le contact avec une souche F+.
La réplication du facteur F a été étudiée en utilisant des mutants thermosensibles. Dans ces expériences, on utilise en général des facteurs F′ (cf. infra) qui portent des marqueurs génétiques faciles à repérer comme le caractère lac+ (utilisation du lactose). Si le facteur F— lac+ est étudié dans une bactérie lac— (incapable d'utiliser le lactose), le caractère lac+ sera un témoin de la présence du facteur F′. Il a été obtenu des mutants thermosensibles de F′ lac+ que l'on désigne Fts-lac+. Dans ces bactéries, le Fts-lac+ se réplique à basse température (25 0C), mais à haute température (42 0C) les bactéries deviennent lac— car le Fts-lac+ ne se multiplie pas. À 42 0C, on trouve cependant quelques clones lac+ : dans ces bactéries, le Fts-lac+ a donc pu se perpétuer. Une étude approfondie de ces bactéries a montré qu'elles ont conservé l'épisome dont la réplication est thermosensible, mais que celui-ci s'est intégré dans le chromosome, et est donc répliqué par le « réplicon chromosome ». Chez ces mutants, le chromosome « sauve » l'épisome de l'effet de la température. De manière réciproque, des mutants de chromosomes bactériens thermosensibles pour la réplication peuvent être sauvés par l'intégration d'un facteur F normal. C'est ici le facteur F qui prend la réplication du chromosome sous son contrôle. L'ensemble de ces expériences illustre précisément les prévisions que l'on pouvait faire à partir de la théorie du réplicon.
Variabilité génétique des bactéries
Les propriétés particulières, qui différencient les bactéries portant le facteur F des bactéries F— dépourvues de ce facteur, sont liées à l'expression de la fonction de transfert du facteur sexuel. Tout d'abord, les bactéries F+ présentent des différences morphologiques liées essentiellement à l'existence à leur surface d'un petit nombre de « poils » spécifiques appelés « F pili ».
Au niveau génétique, la propriété de transfert implique l'existence de deux types de gènes : ceux qui conduisent à la synthèse des F pili et ceux qui permettent à la bactérie donatrice d'injecter le facteur F à la bactérie réceptrice tout en restant elle-même F+. En effet, des mutants du facteur F ont été isolés, qui sont incapables d'assurer leur propre transfert et le transfert de gènes chromosomiques. La plupart de ces mutants sont incapables de synthétiser des F pili ; les autres seraient incapables d'injecter l'ADN dans les bactéries F—. Il semble y avoir indépendance entre la réplication du facteur F et le transfert de l'ADN entre bactéries conjuguantes.
Les bactéries Hfr présentent les mêmes caractères morphologiques que les bactéries F+. Mais les bactéries expriment la fonction de transfert d'une façon différente, liée au fait que le facteur F est intégré dans le chromosome bactérien. Dans ce cas, F est répliqué passivement comme un segment d'ADN chromosomique, mais en revanche « impose » la fonction de transfert à tout le chromosome bactérien. Cela se traduit par les caractères particuliers que présente la conjugaison entre une bactérie Hfr et une bactérie F— : ces croisements produisent beaucoup plus de recombinants qu'un croisement F+ × F— ; la proportion des recombinants est très variable suivant le caractère chromosomique sélectionné (de 10—3 à 10—4) ; la nature des marqueurs transmis à haute fréquence varie avec l'origine de la source Hfr utilisée. En ce qui concerne le facteur sexuel, il n'est pas infectieux dans les souches Hfr, et il est très rarement transmis lors du processus de conjugaison. Jacob et Wollman ont démontré que le transfert des gènes chromosomiques est orienté et progressif. Ces conclusions reposent sur une étude cinétique du processus dans des expériences de conjugaison interrompue permettant de définir l'ordre de succession des gènes dans l'ADN ainsi transféré.
On peut donner actuellement une explication assez claire du comportement des bactéries Hfr. Les bactéries Hfr sont des mutants de bactéries F+ dans lesquelles le facteur F s'est intégré dans le chromosome. Le facteur F est alors capable de promouvoir le transfert de gènes chromosomiques. Le lieu d'insertion du facteur F dans ce chromosome détermine quels seront les marqueurs transmis en premier ou en dernier à partir d'une bactérie Hfr donnée (fig. 4). Le nombre de points d'insertion est élevé mais limité, aussi existe-t-il un nombre limité de types d'Hfr. D'autre part, le chromosome bactérien étant cent fois plus long que le facteur F, le transfert du chromosome est long, peut s'interrompre spontanément par cassure de ce chromosome ou dissociation des paires de bactéries. Cela explique que les gènes proches de la « tête » du chromosome de l'Hfr entreront souvent dans la femelle et donneront de nombreux recombinants, alors que les gènes situés en « queue » seront souvent non transférés. D'autre part, dans les souches Hfr, la réplication du facteur F est liée à celle du chromosome, et ce F ne peut donc être infectieux, comme c'est le cas dans les souches F+.
L'état Hfr est assez instable, et on peut revenir vers l'état F+ par excision du facteur F. Lors de ce processus, il peut se produire diverses anomalies. Cela conduit alors à la formation de plasmides se comportant en épisomes qui portent des fragments de chromosome : ce sont les facteurs F′ déjà cités. Ils conservent en général toutes les caractéristiques de F, mais emmènent des segments d'ADN bactériens de tailles variables, pouvant atteindre 10 p. 100 du chromosome. Des F′ peuvent donc transporter des gènes bactériens d'une souche à une autre. Ce phénomène s'appelle la sexduction. Les facteurs F′ sont très utilisés en génétique bactérienne soit en tant que marqueurs des facteurs F (cf. supra), soit pour construire des diploïdes partiels (mérodiploïdes). Les bactéries sont en effet haploïdes ; et, pour étudier le caractère dominant ou récessif d'une mutation, il faut avoir recours à des artifices génétiques. Les facteurs F et F′ sont donc des outils très utiles en génétique moléculaire.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Patrice COURVALIN : docteur en médecine, chef de l'unité des agents antibactériens à l'Institut Pasteur
- Jacques THÈZE : docteur en médecine, assistant à l'Institut Pasteur
- Patrick TRIEU-CUOT : docteur ès sciences, chargé de recherche à l'Institut Pasteur
- Philippe VIGIER : professeur à l'université de Paris-XI
Classification
Médias
Autres références
-
CHAMPIGNONS
- Écrit par Jacques GUINBERTEAU , Patrick JOLY , Jacqueline NICOT et Jean Marc OLIVIER
- 10 963 mots
- 17 médias
...recombinaisons mitotiques, aptitude qui autorise des échanges génétiques en l'absence des processus sexuels, constitue un phénomène connu sous le nom de parasexualité. La parasexualité se maintient également chez les fungi imperfecti, qui sont, pour la plupart, des ascomycètes dont la reproduction sexuée... -
PHÉROMONES
- Écrit par Charles DESCOINS
- 5 574 mots
Des phéromones sont impliquées dans les phénomènes deparasexualité bactérienne. Par exemple, les souches réceptrices de Streptococcus faecalis sécrètent des phéromones sexuelles de nature peptidique qui induisent des réponses spécifiques chez les souches donatrices portant différents plasmides... -
REPRODUCTION, biologie
- Écrit par Henri CAMEFORT , Jean GÉNERMONT , Didier LAVERGNE et Philippe L'HÉRITIER
- 7 207 mots
- 5 médias
L'avantage résultant du transfert instraspécifique est applicable à laparasexualité bactérienne (cf. plasmides) qui permet l'acquisition par une bactérie de propriétés utiles, telles que la résistance aux antibiotiques, à la suite de phénomènes de conjugaison entre cellules bactériennes... -
WOLLMAN ÉLIE (1917-2008)
- Écrit par Maxime SCHWARTZ
- 1 233 mots
Le Français Élie Wollman, qui a mené toute sa carrière à l'Institut Pasteur, peut être considéré comme l'un des pionniers de la génétique microbienne moderne et, par voie de conséquence, de la biologie moléculaire puis des biotechnologies. Il était aussi devenu la référence pour...
Voir aussi
- RÉPLICATION, biologie moléculaire
- SHIGELLA
- EUCARYOTES
- INFECTION
- GÉNOME
- CHROMOSOMES
- PROCARYOTES ou PROTOCARYOTES
- INFORMATION GÉNÉTIQUE
- RÉSISTANCE BACTÉRIENNE
- RECOMBINAISON GÉNÉTIQUE
- TRANSFORMATION BACTÉRIENNE
- ÉPISOMES
- TRANSDUCTION BACTÉRIENNE
- ADAPTATION BIOLOGIQUE
- ÉPIDÉMIES
- FACTEUR SEXUEL BACTÉRIEN F
- HFR MUTATION
- CONJUGAISON BACTÉRIENNE
- CARACTÈRES, biologie
- TRANSPOSON
- HAEMOPHILUS INFLUENZAE