SURFACE PHÉNOMÈNES DE
Article modifié le
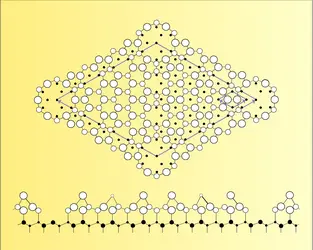
La surface d'un solide ou d'un liquide est une région s'étendant sur quelques distances atomiques qui sépare l'intérieur du matériau du milieu extérieur : en général, le vide ou un gaz. Si le milieu extérieur est une autre phase dense, liquide ou solide, on parle plutôt d'interface entre les deux milieux. Les propriétés physiques et chimiques, structurales et électroniques des surfaces diffèrent notablement de celles du matériau massique : elles évoluent plus ou moins rapidement vers celles du volume, lorsqu'on s'éloigne de la surface vers l'intérieur du matériau. La région frontière est le lieu de phénomènes spécifiques dont l'étude remonte au xixe siècle, lorsque Laplace introduisit la notion de tension superficielle. Il ouvrit alors la voie à un domaine de recherche dont l'importance reste considérable : mouillage, adhésion, lubrification... Plus récemment, vers la fin des années 1960, l'apparition de techniques permettant d'obtenir des vides poussés a donné à la recherche sur les phénomènes de surface un essor nouveau, dont les prolongements dans les domaines technologiques et industriels ont permis de découvrir des matériaux nouveaux, utilisés essentiellement dans l'industrie des semi-conducteurs et de la micro-électronique. C'est la nécessité d'obtenir un haut degré d'intégration pour la miniaturisation des matériels qui a donné aux phénomènes de surface leur rôle essentiel.
Tension superficielle
Définitions
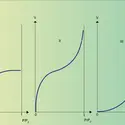
Lorsqu'un système thermodynamique présente deux phases à l'équilibre (un liquide et une vapeur ou un solide et un liquide, par exemple), le paramètre d'ordre (la densité) prend une valeur bien définie dans chacune d'elles. Dans la région où les deux phases se rejoignent, ce paramètre varie continûment de l'une à l'autre. En général, cette variation se fait sur une distance ξ très courte (quelques distances interatomiques pour une interface solide-liquide). On peut définir une surface qui divise le système en deux phases : sa position est quelque peu arbitraire, mais les erreurs introduites sont faibles si la distance ξ est petite devant la taille macroscopique des phases. L'énergie libre d'un tel système est alors la somme des énergies de volume de chacune des phases et d'une énergie libre de surface Fs. La tension superficielle ou interfaciale γ est la variation de cette énergie libre de surface d Fs par unité d'aire d A :

Pour des systèmes isotropes, cette définition thermodynamique est équivalente à une définition mécanique : si la surface est limitée par une ligne L, la tension interfaciale est une force par unité de longueur, perpendiculaire à cette ligne dans le plan de l'interface, qui tend à réduire l'aire de l'interface ; la tension interfaciale est positive et l'énergie libre est minimale pour une aire nulle.
De façon plus microscopique, l'environnement d'un atome n'est pas le même au voisinage de la surface et en volume ; la différence d'énergie d'interaction d'un atome avec son environnement, dans ces deux situations, est à l'origine de la tension interfaciale. Plus quantitativement, la mécanique statistique relie, par exemple, la tension interfaciale liquide-vide aux corrélations de densité dans le liquide.
Les divers facteurs qui influencent la valeur de la tension interfaciale sont discutés dans l'article interfaces. Nous ne revenons ici que sur l'anisotropie du système et l'importance des solutés.
Pour un système anisotrope, un solide monocristallin ou un cristal liquide, par exemple, l'énergie de surface γ dépend de l'orientation de l'interface par rapport à celle de la phase anisotrope ϕ. La tension mécanique de surface ̃γ est alors différente de l'énergie γ, définie de façon thermodynamique :[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean-François JOANNY : docteur ès sciences, chargé de recherche au C.N.R.S.
- Jean SUZANNE : docteur ès sciences, professeur de physique
Classification
Médias
Autres références
-
ADSORPTION
- Écrit par Xavier DUVAL
- 4 819 mots
- 2 médias
L'adsorption est le phénomène qui consiste en l'accumulation d'une substance à l'interface entre deux phases (gaz-solide, gaz-liquide, liquide-solide, liquide-liquide, solide-solide). Il a son origine dans les forces d'attraction intermoléculaires, de nature et d'intensité variées, qui sont responsables...
-
AUGER PIERRE VICTOR (1899-1993)
- Écrit par Bernard PIRE
- 693 mots
Fils d'un universitaire — son père, Victor Auger, était professeur de chimie à la Sorbonne —, le physicien Pierre Auger sut faire succéder à une brillante carrière de chercheur une intense activité de direction scientifique et administrative dont les fruits sont aujourd'hui internationalement reconnus....
-
CATALYSE
- Écrit par Henri Jean-Marie DOU et Jean-Eugène GERMAIN
- 8 396 mots
- 7 médias
...l'explication dite « physique » de la catalyse par l' adsorption dans les pores du solide, qui provoquerait une concentration locale élevée de réactifs. Nous savons maintenant que les phénomènes d'adsorption sont complexes, et qu'il faut distinguer la rétention des molécules à la surface de tous les solides... -
CHIMIE - La chimie aujourd'hui
- Écrit par Pierre LASZLO
- 10 856 mots
- 3 médias
...des réactants le plus souvent en phase gazeuse. Ainsi, les molécules gazeuses diffusent jusqu'à ce qu'elles s'adsorbent (s'accrochent) à des atomes à la surface du catalyseur. On assiste alors à l'affaiblissement ou à la rupture de liaisons chimiques dans les molécules des réactants. Une réorganisation... - Afficher les 17 références
Voir aussi
- PROPAGATION DES ONDES
- CHAMP ÉLECTRIQUE
- LIQUIDE ÉTAT
- COURANT ÉLECTRIQUE
- MICROSCOPIE À EFFET TUNNEL
- DIFFRACTION ÉLECTRONIQUE
- PHASE TRANSITIONS DE
- FUSION
- TRAVAIL DE SORTIE, physique
- BARRIÈRE DE POTENTIEL
- TENSION SUPERFICIELLE
- AMPHIPHILE MOLÉCULE
- GRAPHITE
- TEMPÉRATURE
- SOLIDES PHYSIQUE DES
- KRYPTON
- ÉLECTRONIQUE STRUCTURE
- CAPILLARITÉ
- RICHARDSON-DUSHMAN ÉQUATION DE
- FERMI NIVEAU DE
- MICROSCOPES
- SURFACES ANALYSE DES
- AUGER EFFET
- PHOTOÉMISSION
- SOLIDE ÉTAT
- PHYSISORPTION
- OSCILLATION, mécanique
- PHASES, physico-chimie
- STRUCTURE CRISTALLINE
- YOUNG LOI DE
- TRANSITION RUGUEUSE
- TUNNEL EFFET
- ONDES DE SURFACE