PHOSPHORE
Article modifié le
Le phosphore doit son nom à la lumière qu'il émet par oxydation lente et spontanée, à la température ordinaire. Le moins abondant des éléments de la troisième rangée de la table périodique, il représente environ 1,3 p. 100 de la quantité de silicium que possède l'Univers. Il existe dans la nature à l'état combiné dans un grand nombre de phosphates minéraux : phosphates et fluorophosphates d'aluminium, de fer et de manganèse, de terres rares, uranifères, de plomb et, plus généralement, de phosphates calcaires. On citera plus particulièrement les apatites, et notamment les fluorapatites de formule Ca5(PO4)3F.
Le phosphore intervient dans la métallurgie du fer ; contenu dans certains minerais à l'état de phosphate, il est relâché lors du traitement réducteur des oxydes dans les hauts fourneaux et se retrouve dans les produits sidérurgiques dont il altère les propriétés.
On le rencontre aussi dans les eaux de drainage et les sols, soit à l'état de sels minéraux, soit sous forme de combinaisons complexes avec la matière azotée du sol. Il joue un rôle dans le développement des végétaux qui en contiennent toujours des proportions élevées, d'où l'importance des phosphates dans les engrais.
Le phosphore existe aussi dans les tissus animaux. Il constitue la majeure partie des os et des dents. On le trouve dans l'urine, dans le sang, soit à l'état de phosphate, soit combiné avec des matières organiques (lipidiques, nucléoprotéiques...). L'action du phosphore est décisive dans le métabolisme des êtres vivants puisque, en particulier, l'acide adénosine-triphosphorique est le véhicule de l'énergie.
C'est en 1669 que l'alchimiste allemand Henning Brand découvrit le phosphore en cherchant à extraire la pierre philosophale de l'urine humaine. L'extraction à partir de l'urine fut à nouveau utilisée par Johann Kunckel en Allemagne et Robert Boyle en Angleterre.
Au xviiie siècle, Carl Wilhelm Scheele instituait le procédé de préparation à partir des os d'animaux, procédé qui porte son nom ; mais ce n'est qu'en 1838 que le phosphore commença à être préparé industriellement.
Le phosphore élémentaire
L'atome de phosphore
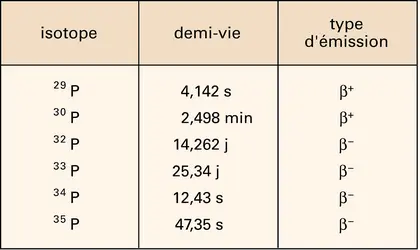
L'atome de phosphore a pour symbole P. Ses numéro et masse atomiques sont respectivement 15 et 30,973 762 (31). On lui connaît vingt-trois isotopes, l'isotope 31P qui est stable et vingt-deux isotopes radioactifs, de 24P à 30P et de 32P à 46P, dont les principaux sont présentés dans le tableau 1.
L'isotope 32P est utilisé comme traceur en physico-chimie et en biologie à la fois pour sa durée de vie relativement longue et pour ses radiations β qui sont suffisamment énergétiques pour être mesurées par les compteurs usuels (tubes Geiger-Müller à parois de verre).

Phosphore : résonance magnétique nucléaire des dérivés phosphorés contenant l'atome 31P
Encyclopædia Universalis France
Le spin nucléaire de l'isotope stable est égal à 1/2(h/2 π) et son moment quadripolaire est nul. Cela est particulièrement intéressant pour l'étude de la structure électronique des molécules ou des ions contenant l'atome 31P par les données de la résonance magnétique nucléaire. Quelques déplacements chimiques caractéristiques sont fournis dans le tableau 2.
Avec un noyau portant une charge positive capable de neutraliser quinze électrons, l'atome neutre de phosphore présente la configuration électronique : 1s2 ; 2s2, 2p6 ; 3s2, 3p3. Dans l'état fondamental, les trois orbitales 3p sont occupées chacune par un seul électron, la distribution électronique est alors de symétrie sphérique et correspond à un état 4S.
Le potentiel d'ionisation, travail nécessaire pour extraire un électron à partir de l'atome, est élevé et augmente avec le degré d'ionisation de l'atome. Pour la première ionisation (3s2, 3p3 → 3s2, 3p2), il vaut 10,9 eV. L'analyse du phosphore par spectroscopie d'émission[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- François MATHEY : professeur à l'École polytechnique, directeur de recherche au C.N.R.S.
- Maurice MAURIN : professeur à l'université des sciences humaines de Nanterre
- Maurice SLANSKY : docteur ès sciences, ingénieur géologue, École nationale des sciences géographiques, conseiller scientifique au Bureau de recherches géologiques et minières
Classification
Médias
Autres références
-
AGRICULTURE - Agriculture et industrialisation
- Écrit par François PAPY
- 7 422 mots
- 3 médias
-
CUIVRE
- Écrit par C.I.C.L.A. et Jean-Louis VIGNES
- 8 231 mots
- 5 médias
Les principaux éléments d'addition sont le phosphore, le zinc et le plomb. -
CYCLES BIOGÉOCHIMIQUES
- Écrit par Jean-Claude DUPLESSY
- 7 882 mots
- 6 médias
Le phosphore (P) est un élément essentiel de la matière vivante, suffisamment rare pour constituer un élément limitant pour de nombreux écosystèmes. -
DÉTERMINATION DE LA STRUCTURE 3D DES PROTÉINES
- Écrit par Beate BERSCH , Juan FONTECILLA-CAMPS et Emmanuelle NEUMANN
- 7 097 mots
- 5 médias
- Afficher les 20 références
Voir aussi
- SULFURES
- ISOTOPES
- GUANO
- MINÉRALE CHIMIE
- OXYDORÉDUCTION
- COURANTS MARINS
- PHOSPHINES
- CYCLIQUES COMPOSÉS
- HYDRURES
- CONDENSATION, chimie
- THIOHALOGÉNURES
- ORTHOPHOSPHOREUX ACIDE
- ORTHOPHOSPHORIQUE ACIDE
- PHOSPHOREUX ACIDE
- PHOSPHORIQUES ACIDES
- PHOSPHINE (phosphure d'hydrogène)
- ANHYDRIDE PHOSPHORIQUE
- ANHYDRIDE PHOSPHOREUX
- OXYHALOGÉNURES
- PHOSPHONITRILE
- THIOPHOSPHATES
- PEROXOPHOSPHATES
- PYROPHOSPHORIQUE ACIDE
- ULTRAPHOSPHATES
- ORGANOPHOSPHORÉS COMPOSÉS
- HYPOPHOSPHOREUX ACIDE
- FLUOROPHOSPHATES
- MÉTAPHOSPHORIQUES ACIDES
- HÉTÉROPOLYACIDES
- HYBRIDATION DES ORBITALES
- HALOGÉNURE DE PHOSPHORE
- OXACIDES ou OXOACIDES
- PHOSPHATES SÉDIMENTAIRES
- RÉDUCTEUR, chimie
- PHOSPHATES
- PHOSPHURES
- OXYCHLORURES
- POLYPHOSPHATES
- PROSPECTION
- TÉTRAÈDRE, stéréochimie
- GISEMENT, géologie
- CONFIGURATION ÉLECTRONIQUE
- ALLOTROPIE
- OXYDES
- YLURES DE PHOSPHORE
- HALOGÉNURES
- CHLORURES
- RÉACTIVITÉ CHIMIQUE
- PHOSPHORE 31