PHOTOCHIMIE
Article modifié le
Théorie de la photochimie
Rendement quantique primaire et rendement quantique global
La notion de rendement quantique est très importante en photochimie. Ce rendement, désigné le plus souvent par Φ, a été défini à l'origine comme étant le nombre de molécules du réactif soumis au rayonnement, ayant donné lieu à une réaction photochimique par photon absorbé.
Soit une réaction qui est représentée par : A hν→ produits. On a par définition :

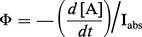
Si une réaction avait lieu chaque fois qu'un photon est absorbé par une molécule, les rendements quantiques seraient tous égaux à l'unité. Or les rendements mesurés varient énormément d'une réaction à l'autre. On trouve des valeurs élevées telles que celles (de 104 à 106) de la réaction du chlore sur l'hydrogène. Φ est très rarement égal à un, comme c'est le cas lorsqu'on éclaire de la benzophénone dissoute dans de l'alcool éthylique :
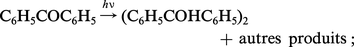
Ces résultats, et tout particulièrement le premier, ne sont compatibles avec la loi de Stark-Einstein que si l'on distingue le rendement quantique primaire du rendement quantique global de la réaction. Pour déterminer le rendement quantique primaire, on essaye de ne tenir compte que de la première étape de désactivation des molécules excitées, laissant de côté les réactions secondaires, qui sont des réactions d'« obscurité » obéissant aux lois de la cinétique chimique classique.
Ainsi, dans le cas de la photolyse du chlore en présence d'hydrogène, on peut distinguer les étapes suivantes :
– l'étape zéro correspond à l'excitation des molécules de chlore :
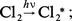
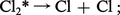
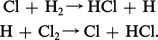
Il est à noter que les atomes de chlore formés par la photodissociation des molécules Cl2* déclenchent une réaction en chaîne qui multiplie l'effet d'un photon, mais pour laquelle la lumière ne joue plus aucun rôle.
Processus de désactivation des états excités
D'une façon générale, les processus photochimiques font partie des différents modes de désactivation des molécules préalablement portées dans leurs états excités métastables par absorption d'un photon.
Le schéma qui rend le plus clairement compte des phénomènes d'absorption et de désactivation est celui connu sous le nom de diagramme de Jablonski-Perrin. Soit une molécule AB représentée sur la figure dans son état fondamental singulet par 1AB0. L'exposant 1 indique que l'état est singulet, c'est-à-dire que la molécule, comme c'est presque toujours le cas, a tous ses électrons appariés ; elle est diamagnétique. Le niveau d'énergie électronique le plus bas, dit fondamental, est représenté schématiquement par un trait plein.
L'excitation par un rayonnement lumineux d'énergie appropriée va promouvoir un des électrons dans un niveau d'énergie électronique supérieur et provoquer des vibrations complexes de la molécule. Cette excitation, qui a lieu dans un temps de l'ordre de 10−17 s, est représentée par une flèche verticale orientée vers le haut.
Par une redistribution de l'énergie vibrationnelle, les molécules retombent très rapidement, en 10−13 s, dans le premier état électronique excité singulet, 1AB*, en équilibre vibrationnel avec le milieu extérieur. La durée de vie de cet état est longue, de 10−9 à 10−7 s, comparativement aux autres états excités. À partir de cet état, plusieurs processus de désactivation[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques JOUSSOT-DUBIEN : docteur ès sciences, professeur, directeur de l'École nationale supérieure de chimie et de physique de Bordeaux.
Classification
Médias
Autres références
-
AÉRONOMIE
- Écrit par Gaston KOCKARTS
- 4 158 mots
- 11 médias
Commele rayonnement solaire est capable de photodissocier et d'ioniser certains constituants atmosphériques, il est évident que les produits de ces processus peuvent réagir chimiquement avec d'autres composés et donner naissance à toute une chimie aéronomique qui est parfois difficile à réaliser au... -
ATMOSPHÈRE - Chimie
- Écrit par Marcel NICOLET
- 3 554 mots
- 5 médias
Il convient tout d'abord de séparer l'action de la radiation solaire ultraviolette en deux domaines distincts correspondant respectivement à la photodissociation et à la photo-ionisation des constituants de l'atmosphère. Le domaine spectral de longueurs d'onde inférieures à 100 nm est lié à l'ionisation... -
CELLULE - L'organisation
- Écrit par Pierre FAVARD
- 11 031 mots
- 15 médias
...chaîne sont des réactions photochimiques qui fournissent l'énergie nécessaire au transport, car celui-ci ne peut se faire spontanément. Chaque réaction photochimique met en jeu une molécule de chlorophylle piège qui est excitée par l'énergie lumineuse qui est collectée par une antenne formée de molécules... -
CHIMIE - Histoire
- Écrit par Élisabeth GORDON , Jacques GUILLERME et Raymond MAUREL
- 11 189 mots
- 7 médias
...réactions induites par des ions lourds accélérés ; ils ont mis au point des méthodes performantes permettant de doser certains éléments à l'état de trace. Les photochimistes, qui s'intéressent aux interactions entre le photon et la matière, ouvrent l'accès à la connaissance de la structure et des états excités... - Afficher les 24 références
Voir aussi