PLASMIDES
Article modifié le
Propriétés des plasmides bactériens
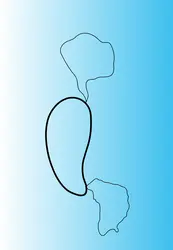
Les plasmides bactériens sont des molécules circulaires (fig. 1) constituées d' ADN double brin (bicaténaire) extrachromosomiques, capables de se répliquer de façon indépendante dans les bactéries hôtes et de se transmettre de façon régulière et stable des bactéries mères aux bactéries filles au cours de la croissance bactérienne, bien que leur présence ne soit pas indispensable au métabolisme normal de l'hôte bactérien : on peut isoler des variants dépourvus de plasmide. Cette perte est définitive, la bactérie « guérie » de son plasmide est incapable d'en générer un nouveau, mais elle peut l'acquérir à partir d'une autre bactérie. La présence d'un plasmide dans une souche bactérienne implique deux propriétés fondamentales : la réplication de l'anneau plasmidique, autrement dit la synthèse de matériel plasmidique par la bactérie hôte, et ensuite le transfert de ce matériel, par différentes voies, entre deux bactéries distinctes, comme s'il s'agissait d'un agent contaminant. Des propriétés adaptatives diverses sont liées à ce transfert plasmidique.
La réplication
On appelle réplication l'ensemble des processus qui aboutissent à la synthèse de nouvelles molécules d'ADN plasmidique ; identiques au plasmide originel, ces copies plasmidiques seront réparties dans les cellules filles au cours de la division bactérienne. Pour qu'un plasmide soit viable, son génome doit contenir nécessairement l'information pour des fonctions minimales ou fonctions d'autonomie qui définissent son individualité : c'est-à-dire sa réplication autonome, le contrôle de cette réplication et de la répartition de ses copies de façon à maintenir un lien constant avec son hôte bactérien.
En 1963, François Jacob, Sydney Brenner et François Cuzin proposent un modèle selon lequel la réplication du plasmide commence en un point précis, l'origine, et progresse d'une manière séquentielle et linéaire vers un autre point spécifique, la terminaison, puis s'arrête ; une substance appelée « initiateur », codée par le plasmide lui-même, déclenche la réplication. La fixation du plasmide à la face interne de la membrane cellulaire est indispensable à la réplication et à la répartition des copies. À un certain stade du cycle de développement de la bactérie, un nouveau site de fixation se formerait, déclenchant la réplication, de telle sorte qu'une nouvelle molécule d'ADN vienne s'attacher au même site. Une cloison entre les deux sites de fixation assure la répartition d'une molécule plasmidique à chaque cellule fille. D'après ce modèle, une très petite partie du génome du plasmide est nécessaire pour assurer les fonctions d'autonomie. L'étude de délétions affectant différents plasmides ainsi que des expériences plus récentes de clonage moléculaire ont permis de confirmer cette hypothèse. Les gènes responsables de l'autonomie, donc de la viabilité du plasmide, sont rassemblés sur ce que l'on appelle une « unité de conduite de réplication », petit segment d'ADN, dont la taille est d'environ 2 000 paires de bases, qui assure la réplication de structures plasmidiques contiguës cinquante fois plus longues. Actuellement, on définit quatre éléments dans l'unité typique de conduite de la réplication : l'origine (site d'initiation de la réplication), la substance initiatrice, les fonctions génétiques qui contrôlent le nombre de copies, et les fonctions qui assurent la répartition des copies dans les cellules filles. Des études utilisant des techniques de coupure de l'ADN plasmidique par des enzymes, les endonucléases de restriction qui coupent l'ADN en des sites spécifiques, ont permis d'isoler les origines de plusieurs plasmides. L'étude de mutants de plasmides instables à des températures élevées a montré qu'il existe un gène codant pour une protéine diffusible nécessaire à la réplication et que cette protéine initiatrice est spécifique de chaque plasmide. La réplication plasmidique n'est pas comme on l'avait d'abord envisagé couplée à la réplication chromosomique et sous son contrôle. La réplication plasmidique est contrôlée indépendamment de la réplication du chromosome.
Le nombre de copies de plasmide par chromosome ou par cellule est très variable selon le plasmide, de une à deux copies à plus d'une centaine de copies ; plus le plasmide est grand, et plus le nombre de copies par cellule est faible. Plusieurs plasmides différents peuvent cohabiter dans la même bactérie avec un nombre de copies très différent, le nombre de copies étant déterminé par un système de régulation propre à chacun d'eux. Pour certains plasmides, il a été démontré que le nombre de copies est contrôlé par une ou plusieurs protéines inhibant la réplication ; il s'agit là d'un modèle de régulation négative par un répresseur. Pour qu'un plasmide présent dans une bactérie en un nombre limité de copies se transmette de façon stable au cours des générations, un mécanisme assurant l'égale répartition des copies dans les cellules filles doit exister. Des études sur des mutants plasmidiques à initiateur de réplication thermosensible ont apporté la preuve de l'existence de ce mécanisme de répartition. Les bactéries hébergeant de tels mutants plasmidiques peuvent encore se diviser à une température de 42 0C, mais la réplication du plasmide ne se fait plus. À chaque génération, les copies se répartissent en nombre égal dans les cellules filles, aboutissant au fil des générations à des bactéries porteuses d'une seule copie plasmidique, puis à des bactéries dépourvues de plasmide et sensibles aux antibiotiques auxquelles elles étaient résistantes grâce à la présence du plasmide. À côté de ces fonctions nécessaires à leur existence même, les plasmides peuvent porter des gènes codant pour de très nombreuses propriétés dont certaines ont des conséquences d'une extrême importance pour l'épidémiologie de la résistance aux antibiotiques et pour la pathogénicité des bactéries.
Le transfert
Classiquement, on divise les plasmides en deux catégories : les plasmides conjugatifs et les plasmides non conjugatifs.
Un plasmide conjugatif code pour des fonctions nécessaires à son transfert d'une bactérie A à une bactérie B ; il est dit autotransmissible :

Les plasmides conjugatifs ont une masse moléculaire supérieure à 30 mégadaltons (Md), leur nombre de copies par chromosome est faible (de 1 à 3), leur présence détermine à la surface de la bactérie la synthèse de pili sexuels nécessaire à la conjugaison. Le transfert est le plus souvent réprimé et s'effectue à faible fréquence, de l'ordre de 10—4 par bactérie donatrice. La conjugaison est réglée par une unité de transcription composée d'une vingtaine de gènes : l'opéron tra. Son déroulement fait intervenir plusieurs étapes successives : interactions pili-paroi aboutissant à la formation d'agrégats de bactéries, synthèse de l' ADN conjugatif ou « mobilisation », transfert dans la bactérie réceptrice d'un seul brin d'ADN plasmidique, synthèse du brin d'ADN complémentaire dans la bactérie receveuse et circulation de l'ADN plasmidique double brin.
Les plasmides non conjugatifs ont une masse moléculaire beaucoup plus petite que les plasmides conjugatifs, le plus souvent autour de 5 Md. Le nombre de copies de ces petits plasmides par copie de chromosome est élevé, supérieur à 10. Ces plasmides ne possèdent pas les gènes nécessaires à la conjugaison, cependant la plupart d'entre eux peuvent assurer l'étape de synthèse de l'ADN conjugatif. Si la bactérie hôte héberge par ailleurs un plasmide autotransférable, au cours de son transfert ce dernier est capable d'assurer le transfert simultané du plasmide non conjugatif par un mécanisme que l'on appelle « mobilisation ».
En définitive, le transfert et la dissémination des plasmides de bactérie à bactérie peut se faire soit par conjugaison, soit par mobilisation. La conjugaison est un phénomène très répandu chez les bacilles à Gram négatif ; plus récemment ce phénomène a été décrit chez les bactéries à Gram positif (streptocoques, staphylocoques, streptomyces, Clostridium...).
Conjugatifs ou non, les plasmides peuvent être disséminés par d'autres mécanismes : ainsi, au cours du transfert par transduction, l'ADN plasmidique est incorporé dans un bactériophage et il est injecté en même temps que l'ADN du phage dans la bactérie réceptrice. Enfin, l'ADN plasmidique peut être acquis par une nouvelle bactérie par un mécanisme de transformation (cf. parasexualité).
Les autres fonctions codées par les plasmides
En plus des gènes qui assurent leur réplication et leur dissémination, les plasmides sont le support d'un grand nombre de déterminants génétiques qui confèrent à l'hôte bactérien des activités biologiques très variées. Les plasmides codant pour la résistance aux antibiotiques ont été les plus étudiés à cause de leur importance clinique. Les plasmides peuvent coder pour la résistance à d'autres agents toxiques pour la bactérie : bactériocines, phages, métaux lourds, détergents, radiations, agents mutagènes, sérum. Les plasmides codant pour des caractères métaboliques confèrent à leurs hôtes la capacité d'utiliser comme aliments de nouvelles substances, leur permettant une meilleure adaptation à l'environnement. Enfin, certains caractères codés par des plasmides jouent un rôle essentiel dans la pathogénicité et la virulence de la bactérie hôte : facteurs d'adhérence, production de toxines, d'hémolysines, capacité d'induire des tumeurs chez les plantes. Un plasmide peut coder, et c'est fréquemment le cas, à la fois pour la résistance aux antibiotiques et une ou plusieurs autres propriétés.
Structure et isolement
Le plasmide est constitué d'une double hélice d'ADN circulaire surenroulé. Chaque brin est formé d'un enchaînement de quatre bases : adénine (A), guanine (G), thymine (T), cytosine (C), qui se succèdent selon une séquence caractéristique. La séquence des bases d'un brin est complémentaire de la séquence des bases de l'autre brin, A correspondant à T et C à G. La taille des plasmides est très variable, de 1/10 à 1/1 000 de la taille du chromosome bactérien.
L'isolement des plasmides peut être réalisé par plusieurs techniques : électrophorèse, ultracentrifugation, microscopie électronique. La microscopie électronique n'est pas un moyen d'isolement mais permet la visualisation et la mesure.
Électrophorèse en gel d'agarose d'un lysat bactérien
Les bactéries sont lysées, l'ADN est extrait, et un échantillon d'ADN purifié est placé dans un puits à l'une des extrémités de la couche de gel. On fait passer un courant électrique. Les molécules d'ADN plasmidiques migrent vers l'électrode positive à une vitesse inversement proportionnelle au logarithme de leur longueur (fig. 2). Les bandes d'ADN dans le gel sont révélées par un colorant fluorescent qui se fixe électivement sur l'ADN, le bromure d'éthidium, et photographiées en lumière ultraviolette. Cette technique est simple, rapide, permet d'analyser un grand nombre de souches en même temps et présente un grand intérêt épidémiologique. Cependant les résultats obtenus par cette technique sont difficilement interprétables lorsque la bactérie héberge plusieurs plasmides de résistance différents, ce qui est fréquent chez les souches résistantes isolées en milieu hospitalier. En effet, chaque plasmide peut donner naissance à plusieurs bandes dans le gel selon sa conformation : structure double brin surenroulée, forme circulaire ouverte par coupure d'un des brins de l'ADN, enfin forme linéaire correspondant à la coupure des deux brins.
Ultracentrifugation en chlorure de césium-bromure d'éthidium
Il est possible d'identifier l'ADN plasmidique et de le séparer de l'ADN chromosomique par centrifugation à très grande vitesse dans un gradient de densité de chlorure de césium (fig. 3). L'ADN plasmidique surenroulé est capable d'intercaler entre ses bases moins de bromure d'éthidium que l'ADN chromosomique linéaire. Cette fixation différentielle crée une différence de densité aboutissant au cours de la centrifugation à la formation dans le gradient de deux bandes séparées correspondant l'une à l'ADN chromosomique, l'autre à l'ADN plasmidique. L'ADN plasmidique ainsi purifié peut être conservé et analysé plus avant par microscopie électronique.
Microscopie électronique
L'examen au microscope électronique d'un étalement du contenu plasmidique d'une souche bactérienne permet de déterminer le nombre de plasmides hébergés par cette souche et de mesurer la taille de chacun des plasmides (fig. 1).
Critères d'identification et classification
Incompatibilité
Deux plasmides identiques ou étroitement apparentés ne peuvent pas coexister de façon stable dans la même bactérie : ils sont dits incompatibles. À partir d'une bactérie dans laquelle on introduit deux plasmides apparentés, au fur et à mesure de la succession des générations, les bactéries filles se divisent en deux populations qui ne possèdent chacune que l'un ou l'autre plasmide. Au contraire, deux plasmides non apparentés peuvent se maintenir de façon stable dans la même bactérie : ils sont dits compatibles. On isole couramment de bactéries multirésistantes six à huit plasmides différents coexistant dans la même bactérie donc compatibles. On définit ainsi des groupes d'incompatibilité. Deux plasmides incompatibles appartiennent au même groupe d'incompatibilité, et deux plasmides compatibles appartiennent à des groupes d'incompatibilité différents. L'incompatibilité est un phénomène que l'on peut observer dans tous les genres bactériens dont on a étudié les plasmides. Cependant, les plasmides d'entérobactéries sont ceux qui ont été les plus étudiés, on distingue une vingtaine de groupes d'incompatibilité différents chez les plasmides d'entérobactéries autotransférables chez Escherichia coli. Les plasmides du même groupe d'incompatibilité ont des tailles comparables, un degré élevé d'homologie entre leurs ADN (cf. infra), une spécificité d'hôte voisine. En revanche, des plasmides appartenant à des groupes d'incompatibilité différents peuvent porter des caractères de résistance aux mêmes antibiotiques, et il n'existe pas de relation entre groupe d'incompatibilité et caractères de résistance codés par les différents plasmides. Le phénomène d'incompatibilité est étroitement lié à la réplication et à la répartition des plasmides ; il semble que des plasmides du même groupe d'incompatibilité possèdent des unités de conduite de réplication identiques, et le même appareil de séparation. Il existerait donc au moins autant d'unités de réplication et de systèmes de répartition que de groupes d'incompatibilité.
Spectre de digestion de l'ADN plasmidique par des endonucléases de restriction
Les endonucléases de restriction sont des enzymes d'origine bactérienne qui coupent l'ADN plasmidique en des sites spécifiques, chacune de ces enzymes reconnaissant une séquence de paires de base particulière. La coupure du plasmide par différentes enzymes de restriction aboutit pour chaque enzyme à une série de fragments d'ADN ; les fragments obtenus sous l'action d'une endonucléase donnée sont séparés par électrophorèse en gel d'agarose selon leur taille. Chaque sorte de plasmide donne ainsi, après traitement par une endonucléase, un diagramme de coupure caractéristique (fig. 4). Deux plasmides ayant des diagrammes de coupure par plusieurs enzymes superposables appartiennent à des espèces moléculaires voisines ou identiques.
Hybridation
La parenté entre les ADN de deux plasmides peut être mesurée par hybridation ; il peut s'agir d'hybridation entre plasmides entiers ou entre fragments d'ADN plasmidique après coupure par une endonucléase de restriction. L'ADN non radioactif du premier plasmide est fixé soit entier, soit après fragmentation et séparation par électrophorèse, sur un filtre, et l'hybridation se fait avec l'ADN radioactif préparé avec l'autre plasmide. La mesure de la radioactivité fixée sur le filtre se fait soit par comptage de la radioactivité dans le cas des plasmides entiers, soit par autoradiographie pour les ADN fragmentés. Les plasmides appartenant au même groupe d'incompatibilité ont un très fort pourcentage d'homologie ADN-ADN.
Analyse d'hétéroduplex en microscopie électronique
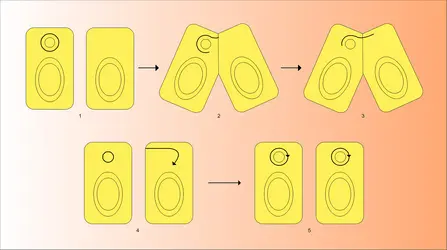
On peut mesurer l'importance de l'homologie entre les ADN de deux plasmides par l'analyse d'hétéroduplex en microscopie électronique (fig. 5). Un hétéroduplex est le résultat de la réassociation de deux brins d'ADN provenant chacun d'un plasmide différent. Les régions constituées de doubles brins d'ADN correspondent aux régions d'homologie. Les boucles simple brin correspondent aux régions hétérologues. Cette technique permet de détecter et de mesurer l'homologie entre deux plasmides.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Annie BUU HOÏ : docteur en médecine, assistant des hôpitaux, chef de travaux
- Michel GUÉRINEAU : maître de recherche au C.N.R.S.
Classification
Médias
Autres références
-
EUCARYOTES (CHROMOSOME DES)
- Écrit par Denise ZICKLER
- 7 724 mots
- 9 médias
...centrale très riche en adénine et thymine (Fitzgerald-Hayes et al., 1982). Ces fragments d'ADN (de 600 à 800 paires de nucléotides) ont été insérés dans des plasmides, molécule d'ADN circulaire, autoréplicable, qui sont eux-mêmes réintroduits dans une cellule de levure. Grâce à un jeu de marqueurs génétiques... -
ANTIBIORÉSISTANCE
- Écrit par Aurélie CHABAUD , Sylvain MEYER et Marie-Cécile PLOY
- 5 907 mots
- 4 médias
Lesplasmides de résistance (en réalité les plasmides porteurs de gènes de résistance) sont les principaux acteurs de la dissémination de ces gènes au sein des populations bactériennes. Les plasmides sont de petites molécules d’ADN circulaire fermées, indépendantes du chromosome bactérien, et capables... -
BACTÉRIES
- Écrit par Jean-Michel ALONSO , Jacques BEJOT et Patrick FORTERRE
- 11 055 mots
- 3 médias
...fonctions non codées par les gènes chromosomiques. Ces ADN extrachromosomiques sont transférables d'une bactérie à l'autre. Il s'agit des plasmides et épisomes. Les plasmides au sens strict sont des ADN extrachromosomiques se répliquant dans le cytoplasme bactérien, indépendamment de la réplication du... -
BACTÉRIOLOGIE
- Écrit par Jean-Michel ALONSO , Jacques BEJOT , Michel DESMAZEAUD , Didier LAVERGNE et Daniel MAZIGH
- 18 335 mots
- 11 médias
...génétique consiste à l'amplification des gènes en amenant les structures qui les portent à être répliquées rapidement. On multiplie ainsi les plasmides, petits morceaux d'ADN circulaires extrachromosomiques au nombre de 2 à 30 par bactérie. Dans certaines espèces, pour amplifier des gènes et... - Afficher les 13 références
Voir aussi
- HYBRIDATION MOLÉCULAIRE
- RÉPLICATION, biologie moléculaire
- SHIGELLA
- EUCARYOTES
- ALIMENTATION ANIMALE, élevage
- AZOTE ATMOSPHÉRIQUE
- BIOLOGIE MOLÉCULAIRE
- RHIZOBIUM
- AZOTE CYCLE DE L'
- CHROMOSOMES
- PROCARYOTES ou PROTOCARYOTES
- RÉSISTANCE BACTÉRIENNE
- STREPTOMYCES
- ÉPISOMES
- ÉPIDÉMIES
- ENZYMES DE RESTRICTION ou ENDONUCLÉASES DE RESTRICTION
- CONJUGAISON BACTÉRIENNE
- GÉNÉTIQUE MOLÉCULAIRE
- TRANSPOSON