POLAROGRAPHIE
Article modifié le
La polarographie est une méthode électrochimique d'analyse, inventée en 1922 par Jaroslav Heyrovsky, de l'université Charles de Prague. Pour sa découverte, il reçut le prix Nobel de chimie en 1959 en raison des possibilités très variées de cette méthode tant en chimie minérale qu'en chimie organique, qu'il s'agisse d'analyse chimique ou d'études ayant un caractère fondamental.
De nombreuses variantes ont été conçues et on parle aujourd'hui des polarographies. Ces méthodes ont en commun l'utilisation d'une électrode particulière appelée électrode à gouttes de mercure à la surface de laquelle on réalise une oxydation ou une réduction électrochimique en appliquant un potentiel selon un programme pré-établi. La mesure du courant d'électrolyse permet d'accéder à la concentration de la substance électrolysée.
Courbes intensité-potentiel et polarographie
Cas général
Soit l'expérience suivante : dans une solution qui contient du fer ferreux Fe2+, on plonge une électrode de potentiel fixe (électrode dite de référence) et une électrode de platine. On augmente alors lentement la différence de potentiel entre les deux électrodes, le montage étant réalisé de façon que l'électrode de platine fonctionne comme anode, c'est-à-dire qu'elle soit le siège d'une réaction d'oxydation. Tant que le potentiel de l'électrode de platine est faible, le courant est nul. Lorsque la tension croît, il arrive un moment où le potentiel de l'anode est suffisamment élevé pour que le fer ferreux soit oxydé en fer ferrique :

Les électrons sont cédés à l'électrode de platine par les ions Fe2+, et un courant électrique circule en sens inverse. Plus le potentiel de l'anode est élevé, plus le courant i est grand, c'est-à-dire plus la réaction électrochimique considérée est rapide.
Mais, pour que les ions Fe2+ soient oxydés à l'anode, encore faut-il qu'ils se déplacent du sein de la solution vers l'anode. D'une façon générale, le transport de matière dans une solution se fait par migration, diffusion et convection. La description que l'on rencontre dans tous les manuels : « Sous l'action du champ électrique, les anions se déplacent vers l'anode et les cations vers la cathode » ne correspond qu'au phénomène de migration, c'est-à-dire au passage du courant dans la solution. Ici, la migration n'est pas favorable à la poursuite de l'électrolyse puisque, par migration, les ions Fe2+ se déplacent vers la cathode et non vers l'anode.
La diffusion est un phénomène général qui se produit chaque fois que dans un fluide les concentrations des différentes substances ne sont pas homogènes et qui tend à annuler ces écarts de concentration. Ainsi, au cours de l'électrolyse considérée, la concentration en Fe2+ au voisinage de l'anode diminue puisque les ions Fe2+ sont consommés à l'anode. Il en résulte un mouvement des ions Fe2+ du sein de la solution vers l'anode.
Enfin, les corps peuvent se déplacer dans la solution, en provoquant une agitation de celle-ci. On parle alors de convection.
En polarographie et, d'une façon générale, dans toutes les méthodes d'analyse électrochimique, on opère dans des conditions telles que les ions à doser ne puissent arriver aux électrodes que par diffusion. À cet effet, on ajoute à la solution un excès de ce qu'on appelle un « électrolyte indifférent », c'est-à-dire un électrolyte dont les ions réagissent plus difficilement aux électrodes que les ions à doser. C'est le cas, par exemple, des perchlorates alcalins, des chlorures alcalins. La concentration de l'électrolyte indifférent doit être de cent à mille fois plus grande que celle du corps à doser. On conçoit dès lors que, étant en excès, les ions de l'électrolyte indifférent assurent pratiquement la totalité du courant par migration.
Au cours de l'électrolyse d'une solution de Fe2+ additionnée d'un excès de perchlorate de sodium par exemple, lorsque le potentiel de l'anode augmente, les ions Fe2+ sont oxydés et le courant croît, mais pas indéfiniment. Il est en effet limité par la vitesse de diffusion des ions Fe2+ à l'électrode, vitesse proportionnelle à la différence entre les concentrations en Fe2+ au sein de la solution et au voisinage immédiat de l'électrode. Lorsque l'électrolyse est suffisamment rapide, la concentration en Fe2+ à l'électrode devient nulle et la vitesse de diffusion de Fe2+ ne peut plus augmenter. Il en résulte que le courant d'électrolyse tend vers une limite que l'on appelle « courant limite de diffusion », proportionnel à la concentration en Fe2+ au sein de la solution. À partir de ce moment, tous les ions Fe2+ qui arrivent à l'électrode sont immédiatement oxydés.
Avec une électrode de surface suffisamment petite pour que l'intensité du courant limite de diffusion soit très faible, la quantité de substance électrolysée est toujours négligeable par rapport à celle qui reste dans la solution. La polarographie est donc une microélectrolyse indicatrice de la concentration de l'espèce électrolysée sans modifier cette concentration.
On obtient une courbe intensité-potentiel telle que celle qui est représentée sur la figure. L'ordonnée limite id est proportionnelle à la concentration de l'ion électrolysé. Sa position dans l'échelle des potentiels, que l'on caractérise généralement par le potentiel pour lequel : i = id/2 (potentiel de demi-vague, E1/2), est caractéristique de l'ion électrolysé. Le tracé des courbes intensité-potentiel peut donc servir à la fois à des fins d'identification et de dosage. Lorsqu'il y a plusieurs corps électrolysables en solution, les intensités sont additives et l'on obtient des courbes semblables à celle de la figure, avec des vagues dont les hauteurs sont proportionnelles aux concentrations des différentes substances électrolysées.
L'électrode à gouttes de mercure
L 'électrode à gouttes de mercure est l'électrode indicatrice utilisée en polarographie. Elle est constituée d'un tube de verre capillaire, de 3 à 5/100 mm de diamètre et de quelques centimètres de longueur, par lequel le mercure s'écoule dans la solution sous forme de fines gouttelettes sphériques se détachant à des intervalles de temps réguliers. L'écoulement du métal est assuré par la pression d'une colonne de mercure de hauteur suffisante pour que le temps de formation d'une goutte (temps de goutte) soit compris entre deux et six secondes.
Cette électrode, en apparence assez compliquée, a été choisie pour tracer les courbes intensité-potentiel parce qu'elle permet d'obtenir des résultats reproductibles. En effet, les caractéristiques géométriques de l'électrode sont bien définies d'une goutte à l'autre si la hauteur de la colonne de mercure est constante. D'autre part, la surface du mercure est sans cesse renouvelée de sorte qu'il n'y a pas de contamination de l'électrode par des substances susceptibles de s'y déposer. Enfin, elle a un avantage commun à toutes les électrodes de mercure : les ions H+ et l'eau y sont beaucoup plus difficilement réductibles que ne le prévoit le potentiel théorique. Par suite, de nombreuses espèces et, en particulier, de nombreux cations métalliques sont plus facilement réductibles que les ions H+ et peuvent être dosés par réduction.
On remarquera qu'en tombant la goutte agite la solution et élimine pour une large part l'effet d'appauvrissement par électrolyse : chaque goutte constitue, à elle seule, une expérience en soi.
Les vagues polarographiques, ou polarogrammes
On appelle « vagues polarographiques », ou polarogrammes, les courbes intensité-potentiel obtenues avec l'électrode à gouttes de mercure. Celle-ci étant constituée par une goutte en formation, sa surface varie continuellement au cours de l'électrolyse. De ce fait, à potentiel constant, le courant d'électrolyse croît en valeur absolue pendant le temps de goutte. L 'équation du courant limite de diffusion a été établie mathématiquement par Ilkovic. On a, à 25 0C :
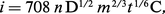
La variation de i en fonction du temps est représentée sur la figure. En principe, le courant s'annule brusquement chaque fois qu'une goutte se détache du capillaire, mais cela ne peut être observé qu'à l'oscillographe cathodique. Dans la pratique, on utilise un galvanomètre dont l'inertie fait que l'on n'observe jamais les courbes courant-temps complètes. Finalement, on obtient des courbes intensité-potentiel présentant des oscillations du courant.
On peut définir un courant moyen pendant la durée de vie de chaque goutte :

τ étant le temps de goutte.
On aboutit à :

Cette expression du courant moyen (de même que celle de i) n'est qu'approchée, et des expressions plus complexes ont été données. Toutefois, les corrections sont faibles, et les expressions précédentes sont largement suffisantes dans la pratique.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Robert ROSSET : docteur ès sciences, professeur à l'École supérieure de physique et de chimie industrielles, Paris, ingénieur, École supérieure de physique et de chimie industrielles
Classification
Médias
Autres références
-
ANALYTIQUE CHIMIE
- Écrit par Alain BERTHOD et Jérôme RANDON
- 8 890 mots
- 4 médias
La voltamétrie est une technique dans laquelle le courant est mesuré en fonction du potentiel imposé. Lapolarographie est une technique voltamétrique dans laquelle on utilise une électrode à goutte de mercure. Dans ces techniques, le courant mesuré est proportionnel à la concentration d'oxydants... -
HEYROVSKY JAROSLAV (1890-1967)
- Écrit par Robert ROSSET
- 196 mots
Chimiste tchèque, Jaroslav Heyrovsky reçut le prix Nobel de chimie en 1959 pour sa découverte de la polarographie.
Né à Prague, où il passa sa vie, Heyrovsky était le fils d'un professeur de droit de l'université Charles de Prague. Il est diplômé de cette même université en 1910, année où il vient...
-
PROTACTINIUM
- Écrit par Robert GUILLAUMONT
- 1 842 mots
- 1 média
...— 1,2 V à partir d'une solution fluorhydrique neutre ou spontanément sur le zinc. En milieu carbonique, il conduit à la formation d'un peroxyde anodique. La polarographie de Pa a été développée en milieux complexants de pH voisin de 7 et dans l'acétonitrile. Deux vagues polarographiques irréversibles apparaissent....
Voir aussi
- IMPULSION, physique
- TENSION ÉLECTRIQUE ou DIFFÉRENCE DE POTENTIEL ÉLECTRIQUE
- COURANT ÉLECTRIQUE
- TRACES ANALYSE DE
- POTENTIEL ÉLECTRIQUE
- DIFFUSION
- ÉLECTRODES
- DOSAGE, chimie
- MERCURE ÉLECTRODE À
- ILKOVIC ÉQUATION D'
- POLAROGRAMME
- CONCENTRATION, chimie
- ÉLECTROLYSE
- SOLUTION, chimie
- SÉLECTIVITÉ, chimie
- ÉLECTROCHIMIE & ÉLECTROLYSE
- COURBE INTENSITÉ-POTENTIEL
- COEFFICIENT DE DIFFUSION







