PROTÉASOME
L'ubiquitination
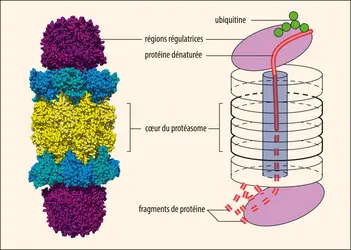
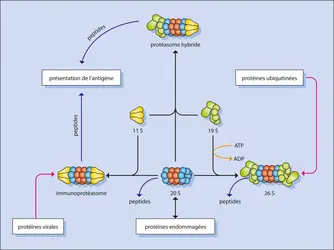
La grande majorité des protéines détruites par la voie ATP-ubiquitine dépendante doivent être étiquetées (marquées) pour être reconnues comme substrat par le protéasome 26S. Ce marquage se fait par l'addition d'une petite protéine ubiquitaire de 76 acides aminés, très conservée au cours de l'évolution, l'ubiquitine. L'ubiquitination est accomplie par l'action séquentielle de trois types d'enzymes spécialisées différentes. Une enzyme d'activation de l'ubiquitine (E1) va se lier à une molécule d'ubiquitine pour donner un complexe E1ubiquitine ; cette réaction est dépendante de l'énergie apportée par l'hydrolyse de l'ATP. Une enzyme de conjugaison à l'ubiquitine (E2) va transférer l'ubiquitine pour donner un complexe E2ubiquitine. Ces enzymes de conjugaison font partie d'une famille dont il existe plus de vingt enzymes connues. Dans une troisième étape, une protéine ligase (E3) va permettre le transfert de l'ubiquitine sur la protéine cible à dégrader. Cette étape se répète par l'addition d'une ubiquitine sur l'ubiquitine précédemment ajoutée, créant une chaîne de polyubiquitine. Pour être reconnue par le protéasome 26S cette chaîne doit posséder un minimum de quatre molécules d'ubiquitine. Près d'une centaine d'enzymes de la famille E3 sont identifiées actuellement. Certaines de ces enzymes sont capables de reconnaître une seule protéine. La combinaison de ces nombreuses enzymes E2 et E3 permet de générer une grande diversité et spécificité dans la reconnaissance des substrats impliquant une ubiquitination.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Yves BRIAND : professeur des Universités
- Encyclopædia Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Médias
Autres références
-
GNF6702, INHIBITEUR DE PROTÉASOMES
- Écrit par Gabriel GACHELIN
- 1 995 mots
- 4 médias
De nombreux parasites comme certaines amibes, certains trypanosomes et des vers, sont responsables de maladies parasitaires graves chez l’humain et d’autres vertébrés. La plus connue de ces maladies parasitaires est assurément le paludisme. Des efforts considérables en matière de financement,...
-
MALADIES NEURODÉGÉNÉRATIVES
- Écrit par Nathalie CARTIER-LACAVE et Caroline SEVIN
- 4 619 mots
- 2 médias
...assurer un contrôle de qualité des protéines synthétisées : des protéines « chaperonnes » sont chargées d'assurer un repliement correct de chaque protéine, le « système UPS » (Ubiquitine-Proteasome System) reconnaît et dégrade les protéines anormales, et le système phagosome-lysosome, par sa fonction d'évacuation... -
ROSE IRWIN (1926-2015)
- Écrit par Encyclopædia Universalis
- 514 mots
Le biochimiste américain Irwin Rose a partagé le prix Nobel de chimie en 2004 avec les Israéliens Aaron Ciechanover et Avram Hershko pour leur découverte conjointe du procédé par lequel les cellules de la plupart des organismes vivants éliminent les protéines défectueuses ou trop vieilles....