RADICAL, chimie
Article modifié le
Radical libre
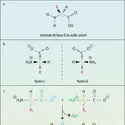
Un radical libre est un radical capable d'existence indépendante, mais cela peut se dire autrement. Dans l'exemple du méthanol H3C-OH, la liaison entre les deux radicaux indiquée par un tiret, est imputable à une paire d'électrons. La scission de la molécule en deux radicaux peut s'envisager avec partage équitable de ces électrons de liaison. Le radical méthyle et le radical hydroxyle deviennent porteurs chacun d'un électron. Un radical libre est donc une entité ayant un électron non apparié. Moses Gomberg (1866-1947) publiait en 1900 ses observations : certaines réactions chimiques forment le radical triphénylméthyle (C6H5)3C. (le point qui suit le symbole C du carbone n'est pas une ponctuation, mais une image de l'électron non apparié). La stabilité de ce radical lui donnait une longue durée de vie, qui se chiffrait en semaines.
Tout au long du xxe siècle, les chimistes ont développé la chimie radicalaire, authentique sous-discipline de la chimie. Ils ont appris à stabiliser les radicaux libres. Celui qu'avait découvert Gomberg tire en partie sa stabilité de ce que les trois volumineux cycles benzéniques (des trois groupements phényle C6H5) enveloppent le carbone radicalaire, celui qui est porteur de l'électron non apparié et font écran à l'approche des atomes d'autres molécules. Un tel encombrement est l'un des moyens de former des radicaux libres stables, à durée de vie prolongée.
On peut aussi diminuer la probabilité d'une rencontre réactive avec d'autres molécules, de diverses manières : en piégeant le radical dans une matrice inerte, d'atomes d'argon par exemple ; en isolant la molécule dans le vide, plutôt qu'en la laissant plongée dans un milieu matériel. Ce dernier cas est celui du milieu interstellaire. Les radiotélescopes permettent d'y voir les signatures spectroscopiques de nombreux radicaux libres. Et l'on peut, par simulation, reproduire en laboratoire la chimie radicalaire qui s'effectue ailleurs dans le cosmos, en particulier à la surface des poussières cosmiques.
Signalons enfin que le mécanisme d'assez nombreuses réactions chimiques fait intervenir des intermédiaires radicalaires.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre LASZLO : professeur honoraire à l'École polytechnique et à l'université de Liège (Belgique)
Classification
Autres références
-
ALCOXYLES RADICAUX
- Écrit par Dina SURDIN
- 50 mots
Groupements de formule générale RO— provenant d'un alcool par élimination d'un hydrogène ; par exemple, le groupement CH3—O— est appelé méthoxy- et provient du méthanol. Le groupement alcoxyle RO— est d'autant plus basique que l'alcool correspondant RO—H est moins acide.
-
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Encyclopædia Universalis et Pierre KAMOUN
- 3 487 mots
- 6 médias
Chaqueaminoacide possède une réactivité propre due à son radical R, déterminant différents tests colorés spécifiques pour l'identification des divers aminoacides ou certaines propriétés particulières comme l'halogénation de la tyrosine (hormones thyroidiennes) et la formation du pont disulfure entre... -
ARYLES RADICAUX
- Écrit par Dina SURDIN
- 34 mots
-
CHIMIE - La nomenclature chimique
- Écrit par Nicole J. MOREAU
- 5 031 mots
- 7 médias
...2, éthène ; CH2=CH-CH2-CH3, but-1-ène ; CH2=CH-CH=CH2, buta-1,3-diène ; HC≡CH, éthyne (ou acéthylène, nom trivial) ; HC≡C-CH3, propyne. Les radicaux sont faits en attachant le suffixe -yl au nom correspondant : -CH2-CH2-CH≡CH-CH3 pent-3-ène-1-yl, le point d'attachement portant le numéro... - Afficher les 10 références