RÉSONANCE, chimie
Article modifié le
Étymologiquement, le mot « résonance » s'applique au renforcement de l'intensité vibratoire ou sonore. Il évoque donc essentiellement un phénomène mécanique. Heisenberg, en 1926, l'utilisa pour la première fois en mécanique quantique dans ses travaux sur les systèmes d'oscillateurs couplés. C'est Pauling, dans ses recherches sur la nature de la liaison chimique, vers 1930, qui l'introduisit en chimie, lui donnant un sens tout différent. Dans l'impossibilité d'attribuer à certaines molécules, le benzène par exemple, une formule unique, on est conduit à envisager la structure réelle comme intermédiaire entre plusieurs formes, dites limites. Bien que sa structure soit unique, on dit que la molécule est dans un état de résonance, ou plus simplement, résonne, entre les diverses formes limites envisagées. Cette situation entraîne des différences notables entre les propriétés physico-chimiques de la molécule réelle et celles que posséderaient les formes limites fictives.
Pour bien saisir le concept de la résonance dans les molécules, il est indispensable de préciser son sens exact en mécanique quantique. En mécanique classique, la résonance n'est en fait qu'un aspect très particulier du couplage entre systèmes vibratoires, qui se manifeste pour certaines valeurs des paramètres définissant ces systèmes par une augmentation très importante de l'intensité vibratoire. Si, dans la théorie des systèmes vibratoires, en mécanique quantique, le couplage se manifeste aussi, la résonance, au sens classique, n'apparaît pas. On sait en effet qu'en mécanique quantique on ne peut connaître simultanément la position et la vitesse d'une particule mais seulement déterminer la probabilité de trouver à un instant t une particule en un point donné, probabilité qui est prise égale au carré du module de la fonction d'onde (cf. mécanique quantique). Dans le cas particulier d'un système isolé, l'énergie est constante et la probabilité en question ne dépend plus du temps, mais seulement du point considéré. On dit que le système est dans un état stationnaire.
Définition
Le problème de la détermination de la structure d'une molécule et de ses propriétés se ramène à la résolution de l'équation de Schrödinger correspondante. Mais cette équation différentielle du second ordre n'est pas intégrable dans le cas général, et des solutions approchées doivent être recherchées. Parmi les méthodes utilisées, le calcul des variations constitue un procédé de choix. Il consiste à chercher pour solution approchée de l'équation de Schrödinger une combinaison linéaire de fonctions d'onde que l'on se donne a priori et auxquelles on demande de former une base de développement acceptable. Dans le cas particulier des molécules, on peut choisir pour base des fonctions d'onde décrivant les diverses paires d'électrons localisées, selon les conceptions classiques, soit entre deux atomes, soit sur un atome. Dans le premier cas, la paire d'électrons est schématisée par un tiret entre les atomes ; dans le second, ou bien on a une paire d'électrons libres, représentés par deux points, comme dans l'ammoniac : NH3, ou bien on a des ions.
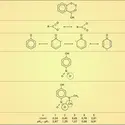
Par construction, la fonction d'onde est donc une combinaison linéaire des diverses fonctions de base introduites. Pour la molécule d'hydrogène, par exemple, on prendra pour base de développement les fonctions correspondant aux trois formes limites : H−H, H+H- et H-H+. Par analogie avec le cas des oscillateurs couplés (cf. oscillateurs et vibrations mécaniques), Pauling a parlé de résonance entre les formes limites qui joueraient ainsi le rôle des oscillateurs indépendants primitifs. Symboliquement, on présente la structure réelle par le schéma conventionnel :

qui évoque une oscillation[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André JULG : professeur émérite à l'université de Provence
Classification
Média
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
...qu'en fait la charge négative est répartie entre les deux atomes d'oxygène, donnant une structure intermédiaire entre les précédentes (on dit qu'il y a résonance entre celles-ci). La structure réelle est toujours plus stable que celle des formes en résonance (la différence des énergies correspondantes... -
CHIMIE THÉORIQUE
- Écrit par Lionel SALEM et François VOLATRON
- 4 290 mots
- 10 médias
...fonctions d'onde correspondant à ces deux structures. Chimiquement, cette construction est d'autant plus satisfaisante qu'elle s'accorde avec la notion de résonance introduite par Pauling, dans laquelle la molécule de benzène est supposée en quelque sorte alterner entre ces deux structures (ou en tout... -
COORDINATION (chimie) - Composés de coordination
- Écrit par Jean AMIEL et Jean-Pierre SCHARFF
- 4 895 mots
- 4 médias
Lesrésonances augmentent toujours la stabilité des complexes ; pour qu'elles aient lieu, il faut que ceux-ci aient une structure plane ou s'écartant peu de la planéité ; l'augmentation du domaine offert aux électrons délocalisés accroît encore la stabilité ; c'est le cas des porphyrines ou, mieux encore,... -
ISOMÉRIE, chimie
- Écrit par Pierre LASZLO
- 1 787 mots
- 1 média
...rendre compte de l'indiscernabilité, et donc de la délocalisation des électrons au sein de n'importe quelle molécule. Son apport, outre cette synthèse, fut la notion de résonance : les molécules de la chimie, comme des cordes vibrantes, ou des oscillateurs quelconques, peuvent entrer en résonance.
Voir aussi