RÉSONANCE, chimie
Article modifié le
Quelques applications
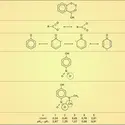
C'est surtout dans le domaine des molécules conjuguées que la notion de résonance a été appliquée. Le cas le plus typique est celui du benzène. Les trois doubles liaisons du schéma classique de Kekulé ne sont pas indépendantes mais ont fusionné en un système unique, totalement symétrique, le noyau benzénique. Sans atteindre ce degré d'importance, le phénomène subsiste dans des molécules comme le butadiène où les doubles liaisons sont encore reconnaissables. Cette réorganisation des électrons est aussi connue sous le nom de conjugaison des systèmes insaturés. Cette appellation est préférable au mot « résonance », car non seulement elle n'évoque pas d'image fausse, mais, étymologiquement, elle signifie bien que les systèmes primitifs ont fusionné en un seul.
L'établissement de la conjugaison entre les diverses liaisons doubles ou triples d'une molécule, ou encore d'un système de liaisons multiples avec les électrons d'une paire libre portée par un atome voisin, se traduit par un certain nombre de modifications des propriétés physico-chimiques par rapport aux schémas de référence fictifs donnés par la graphie classique.
Modification des longueurs des liaisons
Pour le benzène, par exemple, toutes les liaisons chimiques sont égales (0,140 nm), ce qui correspond à un allongement des doubles liaisons, qui, isolées, mesureraient 0,133 nm, et à un raccourcissement des simples liaisons, qui, isolées, mesureraient 0,152 nm. Dans le butadiène, l'effet est moins marqué, mais la différenciation entre les liaisons terminales (0,134 nm) et la liaison centrale (0,147 nm) reste très nette.
L'effet est surtout sensible lorsque le système conjugué possède un hétéroatome, comme dans l'acroléine. À partir de l'atome d'oxygène, plus électronégatif que les carbones, on observe une polarité alternée : C+−C-−C+−O-. Le phénomène peut se manifester aussi avec des atomes de même nature, comme dans le fulvène (formule), ce qui entraîne l'apparition d'un moment dipolaire d'environ 1 debye.
Modification des spectres d'absorption
En général, la conjugaison se traduit par un déplacement de la première bande d'absorption électronique vers les grandes longueurs d'onde (effet bathochrome) et par un abaissement des fréquences de vibration des divers groupements de la molécule.
Stabilisation énergétique
Toutefois, le phénomène majeur pour le chimiste est la stabilisation de la molécule conjuguée par rapport à la molécule fictive non conjuguée. L'effet peut être chiffré par l'abaissement d'énergie correspondant, appelé énergie de résonance ou de conjugaison. Parmi les applications les plus intéressantes, il y a lieu de mentionner le cas des systèmes en équilibre que la conjugaison va orienter dans un sens bien déterminé. Par exemple, lorsqu'on a deux isomères, comme dans le cas d'une cétone et de sa forme énolique (formule), la forme cétonique est plus stable que la forme énolique, d'où la prépondérance à peu près exclusive de la première dans les cétones non conjuguées.
Si un système insaturé est greffé sur le carbone porteur de l'hydrogène, la forme énolique sera plus stabilisée que la forme cétonique. Dans le cas du phénol, la forme énolique pourra devenir prépondérante.
Le cas des réactions où plusieurs isomères sont susceptibles de se former est semblable. Par le jeu des équilibres qui s'établissent, c'est l'isomère le plus conjugué, car le plus stable, qui sera prépondérant.
Un autre exemple typique d'application est le renforcement de l'acidité des acides carboxyliques conjugués : ce phénomène est dû au fait que l'ion carboxylate R−CO-2 est plus conjugué que l'acide lui-même R−CO2H et, par conséquent, plus stabilisé quand le radical R est un groupement insaturé comme dans le cas de l'acide benzoïque C6H5−CO2H.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André JULG : professeur émérite à l'université de Provence
Classification
Média
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
...qu'en fait la charge négative est répartie entre les deux atomes d'oxygène, donnant une structure intermédiaire entre les précédentes (on dit qu'il y a résonance entre celles-ci). La structure réelle est toujours plus stable que celle des formes en résonance (la différence des énergies correspondantes... -
CHIMIE THÉORIQUE
- Écrit par Lionel SALEM et François VOLATRON
- 4 290 mots
- 10 médias
...fonctions d'onde correspondant à ces deux structures. Chimiquement, cette construction est d'autant plus satisfaisante qu'elle s'accorde avec la notion de résonance introduite par Pauling, dans laquelle la molécule de benzène est supposée en quelque sorte alterner entre ces deux structures (ou en tout... -
COORDINATION (chimie) - Composés de coordination
- Écrit par Jean AMIEL et Jean-Pierre SCHARFF
- 4 895 mots
- 4 médias
Lesrésonances augmentent toujours la stabilité des complexes ; pour qu'elles aient lieu, il faut que ceux-ci aient une structure plane ou s'écartant peu de la planéité ; l'augmentation du domaine offert aux électrons délocalisés accroît encore la stabilité ; c'est le cas des porphyrines ou, mieux encore,... -
ISOMÉRIE, chimie
- Écrit par Pierre LASZLO
- 1 787 mots
- 1 média
...rendre compte de l'indiscernabilité, et donc de la délocalisation des électrons au sein de n'importe quelle molécule. Son apport, outre cette synthèse, fut la notion de résonance : les molécules de la chimie, comme des cordes vibrantes, ou des oscillateurs quelconques, peuvent entrer en résonance.
Voir aussi