SÉROTONINE
Article modifié le
Métabolisme
Méthodes d'étude
La mise en évidence des potentialités de synthèse et de dégradation de la 5-HT d'un organe ou d'un tissu peut se faire in vivo ou in vitro. Par exemple, in vivo, la présence de 5-HT tritiée dans le cerveau après injection intraveineuse ou intracisternale de tryptophane tritié (la barrière hémato-encéphalique empêche le passage de la 5-HT de la périphérie au cerveau) constitue une preuve de la synthèse cérébrale de l'indole-amine. In vitro, l'incubation de coupes ou d'homogénat de tissus en présence de tryptophane permet de suivre sa transformation éventuelle en 5-HT. Chez l'homme, l'étude de ce métabolisme est réalisée par dosage de l'amine ou de ses métabolites dans les liquides physiologiques (urine, liquide céphalo-rachidien). Le métabolisme de l'amine dans tel ou tel organe est mesuré par un paramètre, le temps de renouvellement ou de turnover : c'est le temps qu'il faut pour que soit renouvelée la moitié du contenu en 5-HT d'un organe ou d'un tissu. Il est particulièrement bref dans le système nerveux central et peut varier selon les situations physiologiques ou pharmacologiques.
Biosynthèse
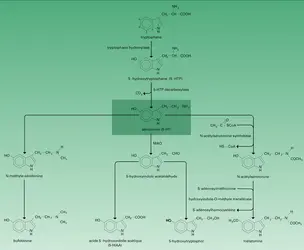
La biosynthèse de la 5-HT a lieu dans le foie, le tractus gastro-intestinal, le cerveau et dans différents types cellulaires tels que les cellules entérochromaffines, les neurones, les pinéalocytes. La description suivante vaut pour le système nerveux central.
Dans une première étape, l' acide aminé précurseur, le L-tryptophane, pénètre dans les cellules grâce à un système de transport actif. Dans le système nerveux central, la synthèse dépendrait à chaque instant de l'apport sanguin de cet aminoacide essentiel.
Dans la cellule, le tryptophane est hydroxylé avec transfert de l'atome d'hydrogène du carbone 5 au carbone 4. Cette réaction fait intervenir l'oxygène gazeux. L'enzyme spécifique qui catalyse la transformation du tryptophane en 5-HTP, la tryptophane hydroxylase, a un Km pour le tryptophane du même ordre de grandeur que la concentration tissulaire en aminoacide (Km = 2 × 10-5M). Son activité, au niveau du système nerveux central, est extrêmement faible (Vmax = 2μg/g/h dans le tronc cérébral), ce qui rend son étude difficile. Le cofacteur de cette enzyme est un dérivé ptéridinique réduit, la tétrahydrobioptérine.
Le L-5-HTP formé est ensuite décarboxylé par la 5-HTP décarboxylase. Cette enzyme est en fait la même que la dopa décarboxylase ou la L-aminoacide aromatique décarboxylase. Le cofacteur de cette enzyme est le pyridoxal phosphate.
La 5-HT est alors stockée dans des vésicules synaptiques où elle se lie à des macromolécules protéiques selon le processus décrit pour les bases de Schiff. L'ATP intervient dans la constitution de ces granules. Elle peut ensuite être libérée dans l'espace synaptique, atteindre un récepteur postsynaptique qui serait de nature lipoprotéique et entraîner des changements du potentiel membranaire du neurone cible.
Des agents pharmacologiques permettent de modifier les différentes étapes enzymatiques. En effet, la capture du tryptophane peut être inhibée compétitivement par d'autres aminoacides (phénylalanine, par exemple) ; dans ce cas, la synthèse de la 5-HT directement liée au taux de la tryptophane est diminuée (carence à l'origine de l'oligophrénie phénylpyruvique, cf. chap. 4, Les Maladies du système nerveux central). En outre, la très grande sensibilité du tryptophane hydroxylase aux dérivés catéchols serait à l'origine de certains types de dépressions observées chez les parkinsoniens en cours de traitement à la L-dopa ; celle-ci inhiberait l'enzyme et entraînerait une baisse de la synthèse de la 5-HT dans le système nerveux central. Par ailleurs, il est vraisemblable que la L-dopa inhibe également en partie la décarboxylation du 5-HTP.
Catabolisme et inactivation
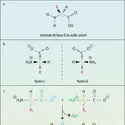
L'inactivation de la 5-HT, c'est-à-dire la transformation de l'amine susceptible d'agir au niveau d'un récepteur spécifique en un produit inapte à cette fonction, peut être d'ordre métabolique ou non. L 'inactivation catabolique, présynaptique ou postsynaptique, fait intervenir la forme A de la monoamine oxydase ( MAO A). Cette enzyme mitochondriale catalyse la désamination oxydative de la 5-HT qui aboutit à la formation d'un composé instable : le 5-hydroxyindole acétaldéhyde. Ce dernier est ensuite soit réduit en 5-hydroxytryptophol, soit, et c'est la voie majeure, oxydé en acide 5-hydroxyindole acétique (5-HIAA), métabolite présent dans les urines (2 à 8 mg par jour chez l'homme).
Lorsque la monoamine oxydase est inhibée par des drogues, comme la pargyline ou la phéniprazine (IMAO), la 5-HT semble emprunter des voies cataboliques qui n'interviennent pas dans les conditions normales. Si l'existence d'un mécanisme de conjugaison, avec des sulfates, par exemple, n'a jamais été clairement établie, en revanche on a pu déceler la présence de dérivés méthylés, telle la NN-diméthyle 5-hydroxytryptamine, ou bufoténine.
Une autre voie catabolique pour la 5-HT existe dans les pinéalocytes de la glande pinéale, ou épiphyse. L'amine, synthétisée à partir du tryptophane, est acétylée par une enzyme spécifique : la N-acétyltransférase, enzyme dont l'activité dépend étroitement de la photopériode. L'acétylcoenzyme A fournit le groupement acétate. La N-acétylsérotonine est ensuite méthylée par l'hydroxyindole-0-méthyle transférase. Le produit formé, la N-acétyl 5-méthoxytryptamine, est encore appelé mélatonine.
Régulation de la biosynthèse
La régulation de la biosynthèse est assez mal connue. Compte tenu du fait que la concentration cérébrale en tryptophane est le facteur limitant de la synthèse, le système de transport actif pour cet aminoacide dans les neurones sérotoninergiques pourrait être le site d'intervention de facteurs de la régulation. Bien qu'un mécanisme de feed-back négatif ait été décrit, comme dans le cas de la biosynthèse centrale des catécholamines, mais avec un seuil de déclenchement beaucoup plus élevé, de fortes concentrations en 5-HT sont incapables de ralentir aussi bien la vitesse d'entrée du tryptophane que l'activité tryptophane hydroxylase d'un homogénat de cerveau. Des données (A. Tagliamonte et al., 1971) semblent en faveur de l'intervention de l'AMP cyclique trouvé en grande quantité dans le cerveau ; celui-ci serait capable d'y augmenter, in vivo et in vitro, l'accumulation de tryptophane et, par suite, la synthèse de 5-HT. En outre, les fluctuations du métabolisme de la 5-HT dans le système nerveux central au cours du nycthémère dépendraient directement de modifications qui concernent d'abord le système de transport actif du tryptophane dans les cellules.
Certaines situations conduisent à des changements spécifiques de l'activité de la tryptophane hydroxylase. En particulier, les corticostéroïdes, en activant la néosynthèse de l'enzyme, peuvent être responsables de l'augmentation de la synthèse cérébrale de 5-HT au cours de certains stress.
Enfin, il a été montré que des changements de la fréquence des potentiels d'action dans les neurones sérotoninergiques centraux pouvaient retentir sur la vitesse de biosynthèse de la 5-HT dans le cerveau. Le mécanisme impliqué semble faire intervenir une réaction de phosphorylation de la tryptophane hydroxylase déclenchée par l'entrée de Ca2+ dans les terminaisons au moment de l'arrivée de l'onde de dépolarisation.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Michel HAMON : docteur ès sciences naturelles, agrégé de physiologie-biochimie, maître de recherche à l'I.N.S.E.R.M.
Classification
Média
Autres références
-
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Encyclopædia Universalis et Pierre KAMOUN
- 3 487 mots
- 6 médias
...L' aromatique L aminoacide-décarboxylase permet la décarboxylation de la 3,4dihydroxy-phénylalanine (DOPA) en dopamine, de l'hydroxy5 tryptophane en hydroxy5 tryptamine (ou sérotonine), de la phénylalanine en phényléthylamine, de la tyrosine en tyramine, du tryptophane en tryptamine, de l'histidine... -
BUFOTÉNINE
- Écrit par Michel HAMON
- 481 mots
Alcaloïde indolique isolé pour la première fois des glandes cutanées des crapauds (Bufo sp.). Il s'agit, en réalité, d'un dérivé de la sérotonine, la N,N-diméthyl-sérotonine.
Administrée à l'homme, la bufoténine provoque des effets mixtes, périphériques et centraux, de courte...
-
CHIMIE - La chimie aujourd'hui
- Écrit par Pierre LASZLO
- 10 856 mots
- 3 médias
De façon parallèle, dans le réseau cérébral dont lasérotonine est le neurotransmetteur, certains antidépresseurs bloquent sa réabsorption. Car la maladie mentale qu'est la dépression voit une altération des équilibres physiologiques entre les neurotransmetteurs que sont sérotonine, norépinéphrine... -
DOULEUR
- Écrit par François BOUREAU et Jean-François DOUBRÈRE
- 4 970 mots
- 1 média
...déterminer une analgésie marquée. Le circuit le mieux étudié implique la substance grise de la base du cerveau (périaqueducale et périventriculaire) riche en sérotonine. Elle agirait sur le noyau du raphe magnas (NRM), situé dans le bulbe, et sur le pont, qui est à l'origine d'une voie descendante inhibitrice... - Afficher les 20 références
Voir aussi
- VASOCONSTRICTION
- COAGULATION DU SANG
- INTESTIN
- NEUROLOGIE CLINIQUE
- NEUROPHARMACOLOGIE
- MAO (monoamine oxydase)
- PLAQUETTES SANGUINES ou THROMBOCYTES
- DÉSAMINATION
- NEUROCHIMIE
- MÉTABOLISME CELLULAIRE
- INHIBITEURS, biochimie
- MÉDIATEURS BIOCHIMIQUES
- SOMMEIL LENT
- SCHIZOPHRÉNIE
- MÉTABOLIQUES MALADIES
- ANALGÉSIE
- BIOSYNTHÈSES
- TRYPTOPHANE
- PHÉNYLCÉTONURIE ou OLIGOPHRÉNIE PHÉNYLPYRUVIQUE
- NEURONES SÉROTONINERGIQUES
- L-DOPA
- MESSAGER, biochimie
- RÉGULATIONS BIOCHIMIQUES
- CHOC ANAPHYLACTIQUE
- HYDROXYLASE
- DÉFICITS ENZYMATIQUE & MÉTABOLIQUE