SEXUALISATION, biologie
Article modifié le
Hormones sexuelles : rôle des androgènes
Le rôle des estrogènes est étudié dans l'article appareil génital : ils sont responsables de la morphogenèse « neutre » à savoir féminine. Nous ne l'envisagerons pas ici. Les androgènes ont longtemps été considérés comme des hormones exclusivement virilisantes, c'est-à-dire responsables de la différenciation et du développement de l'appareil génital masculin ; leurs actions physiologiques sont, en fait, beaucoup plus étendues et concernent de nombreux tissus. Les androgènes agissent notamment sur la croissance des os et le métabolisme musculaire, mais également sur le maintien en vie des motoneurones du système nerveux central.
D'un point de vue biochimique, les androgènes sont des stéroïdes comportant dix-neuf atomes de carbone, avec une fonction oxygénée sur les carbones 3 et 17. Cependant, parmi ces molécules, il faut distinguer les androgènes actifs – la testostérone (T) et la dihydrotestostérone (DHT) – des précurseurs inactifs et des métabolites. L'activité androgénique dépend de la capacité de l'androgène à se fixer ou non au « récepteur des androgènes » qui est le médiateur obligatoire de l'action cellulaire des androgènes.
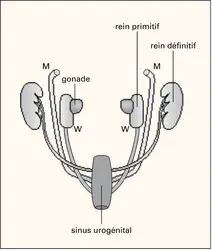
Au niveau des organes génitaux, pendant la vie fœtale, les androgènes actifs induisent la virilisation du tractus urogénital selon deux voies. La testostérone agit directement sur les canaux de Wolff et permet ainsi le développement des épididymes, des canaux déférents et des vésicules séminales. En revanche, au niveau du sinus urogénital et des organes génitaux externes, elle sert de prohormone pour la synthèse de DHT, laquelle déclenche le développement de l'urètre et de la prostate et permet aussi la formation du pénis et du scrotum.
La transmission du message androgène
Les mécanismes de transmission du message androgène dans une cellule cible comportent deux étapes fondamentales : il s'agit, d'une part, de la conversion, dans certains tissus, ci-dessus énumérés, de la T en DHT grâce à l'action d'une enzyme, la 5α-réductase (conversion qui correspond à une amplification du signal androgène) et, d'autre part, de la mise en jeu, pour la T comme pour la DHT, d'un récepteur hormonal spécifique, le récepteur des androgènes, médiateur obligatoire de l'action des androgènes.
L'enzyme de la morphogenèse masculine
La 5α-réductase, ou 5αR, est une enzyme membranaire microsomale, NADPH-dépendante. Elle est responsable de la transformation de T en DHT. Certaines données cliniques biochimiques et génétiques (en particulier l'étude des déficits en 5α-réductase, forme rare de pseudohermaphrodisme masculin) ont abouti, au début des années 1990, à l'hypothèse de l'existence de deux 5αR distinctes, les types 1 et 2 ; leur existence a été confirmée par suite du clonage et du séquençage de deux gènes différents codant pour ces deux enzymes. Le gène codant pour le type 1 est situé sur le chromosome 5, celui codant pour le type 2 sur le chromosome 2. Bien qu'exerçant la même activité enzymatique sur les mêmes substrats, les enzymes type 1 et type 2 ne présentent qu'environ 50 p. 100 d'homologie dans leur composition en acides aminés. Elles se différencient, sur le plan fonctionnel, par quatre points essentiels : leur pH optimal d'activité, la sensibilité à l'action inhibitrice du finastéride, leur distribution tissulaire et l'ontogenèse de leur expression. La 5αR de type 1 est essentiellement exprimée dans le foie et dans la peau non génitale, alors que la 5αR de type 2, bien qu'exprimée dans le foie également, n'est retrouvée qu'au niveau des organes génitaux externes.
Le récepteur des androgènes
Le récepteur des androgènes appartient à la famille des récepteurs nucléaires (récepteurs des hormones stéroïdes et thyroïdiennes, de la vitamine D, de l'acide rétinoïque...), ainsi nommés car ils sont actifs dans le noyau des cellules cibles. Le gène (subdivisé en huit structures actives ou exons, reliées par des introns inactifs), qui code pour l'expression dudit récepteur, est situé sur le chromosome X en position q11-12. Ce récepteur est une protéine qui partage, avec tous les récepteurs nucléaires, une structure générale en trois domaines fonctionnels : un domaine NH2-terminal codé au niveau de l'ADN par l'exon 1 (principalement impliqué dans la régulation de l'expression des gènes androgénorégulés), un domaine central de liaison à l'ADN codé par les exons 2 et 3 (il est constitué de deux structures en doigt de gant), et un domaine COOH-terminal, siège de la liaison avec l'hormone et qui est codé par les exons 4 à 8. L'action de la testostérone ou de la DHT s'exerce par l'intermédiaire de leur récepteur spécifique, unique, le récepteur des androgènes. Celui-ci se comporte au niveau de l'ADN, où il va se fixer, comme un facteur de transcription androgénorégulé.
Mécanisme d'action des androgènes
On peut schématiquement décomposer le mécanisme d'action des androgènes en quatre étapes : la liaison de l'androgène au récepteur dans le cytoplasme des cellules cibles, la migration du complexe hormone-récepteur dans le noyau, la fixation sur l'ADN, la transcription des gènes androgénorégulés.
Liaison de l'androgène au récepteur
En l'absence d'hormone, le récepteur des androgènes se trouve dans le cytoplasme de la cellule cible à l'état inactivé par suite du masquage des sites de liaison avec l'hormone et ceux de fixation à l'ADN par trois protéines dites chaperonnes (les protéines de choc thermique HSP). Les protéines chaperonnes joueraient un rôle dans la localisation cytoplasmique du récepteur. Il est maintenant admis que la fixation de l'hormone entraîne une libération de ces chaperonnes. De plus, la liaison de l'hormone entraîne une hyperphosphorylation (de 2 à 7 fois) par rapport au niveau basal. Le rôle de cette augmentation de phosphorylation est inconnu, mais plusieurs hypothèses ont été avancées : le transport du récepteur au sein du noyau, la modulation de la liaison à l'ADN, la dimérisation du récepteur, l'interaction avec d'autres facteurs de transcription et l'augmentation de la demi-vie de la protéine expliqueraient que l'hyperphosphorylation soit nécessaire.
Migration vers le noyau
La localisation nucléaire du récepteur activé est due à un « signal de transfert nucléaire » ; cette partie de la molécule est localisée dans la région dite charnière (entre les domaines de liaison de l'hormone et le domaine de liaison à l'ADN). Elle est constituée de deux séquences de quatre à cinq acides aminés basiques séparés par dix acides aminés. Pour les récepteurs des glucocorticoïdes et des minéralocorticoïdes (qui présentent une grande homologie avec celui des androgènes), il a été montré que ces récepteurs sont associés au cytosquelette cellulaire (complexe actine-microtubules) et que le déplacement du récepteur vers le noyau était réalisé en association avec les protéines HSP90 le long de ces structures de soutien dans le cytoplasme puis à travers les pores nucléaires.
Fixation du complexe récepteur-androgène sur l'ADN
La fixation du récepteur des androgènes (sous forme d'homodimère) a lieu au niveau de séquences cibles spécifiques. Ce sont les éléments de réponse aux androgènes (ARE), habituellement situés en amont des gènes androgénorégulés, au niveau de leur promoteur.
Transcription des gènes androgénorégulés
La fixation du récepteur sur l'ADN entraînerait des modifications de la structure de l'ADN dont une des étapes serait le déplacement, ou le départ, de nucléosomes. Cette modification de la structure chromatinienne permettrait l'accès aux gènes cibles des facteurs de transcription accessoires et des enzymes de la machinerie transcriptionnelle comme l'ARN polymérase II. Il en résulte la synthèse d'un préARN messager, ou ARNm nucléaire. Pour devenir un ARN messager ou ARNm, apportant aux ribosomes du cytoplasme l'information qui leur est nécessaire, le préARNm doit être modifié (excision des introns puis épissage entre exons). Après élaboration, la protéine synthétisée subira des modifications posttraductionnelles (glycosylation...) puis sera acheminée (adressage) vers les différents compartiments cellulaires pour entraîner la réponse cellulaire androgénique. On comprend, dès lors, qu'une anomalie de cette séquence complexe d'événements soit responsable d'un défaut d'action des androgènes et génère ainsi une résistance aux androgènes.
Les résistances aux androgènes
Les syndromes de résistance, ou d'insensibilité, aux androgènes ont été décrits dans quatre types de pathologie affectant la morphologie (phénotype) des individus atteints. Il s'agit principalement des pseudohermaphrodismes masculins définis par le défaut de virilisation des structures génitales chez un individu à caryotype masculin (formule chromosomique 46,XY). Les résistances aux androgènes représentent plus de 50 p. 100 des cas de pseudohermaphrodisme masculin. D'un point de vue clinique, on distingue habituellement deux formes de résistance aux androgènes :
– la forme dite « complète », correspondant à un phénotype parfaitement féminin, dont l'expression clinique est caractérisée, habituellement à l'adolescence, par l'association d'une aménorrhée primitive, d'une absence de pilosité pubienne et d'un développement mammaire volumineux ;
– la forme dite « partielle », qui couvre un plus large spectre clinique, allant de l'ambiguïté sexuelle profonde à l'absence d'anomalie des organes génitaux externes chez un homme stérile. Le déséquilibre hormonal affecte la production d'androgènes, mais aussi, du fait de l'absence de rétrocontrôle négatif, le taux des hormones LH et FSH de l'axe hypothalamo-hypophysaire.
Une résistance aux androgènes est également retrouvée dans la maladie de Kennedy ou amyotrophie spinobulbaire liée au chromosome X, qui est une dégénérescence lente et tardive des muscles proximaux. Des anomalies du récepteur des androgènes ont été également décrites dans le cancer du sein des sujets masculins et dans le cancer de la prostate.
Les anomalies du gène du récepteur des androgènes ont été retrouvées principalement dans les syndromes de résistance aux androgènes responsables d'une anomalie de la différenciation sexuelle. Elles se regroupent en quatre catégories : les anomalies structurales majeures du gène, les anomalies structurales mineures, les mutations ponctuelles qui altèrent la structure de l'ARNm et les mutations ponctuelles qui modifient la structure primaire de la protéine.
Les altérations majeures du gène du récepteur des androgènes
Elles sont principalement représentées par les macrodélétions du gène, c'est-à-dire la perte d'une quantité importante de matériel génétique pouvant aller jusqu'à la perte totale du gène, soit environ 100 kilobases. Comme pour d'autres maladies génétiques, les macrodélétions sont exceptionnelles. À ce jour, une dizaine de délétions plus ou moins complètes du gène du récepteur ont été décrites : neuf dans des cas de résistance complète aux androgènes et une délétion de l'exon 4 chez un patient présentant un syndrome d'Aiman (oligo-azoospermie).
Les altérations mineures du gène du récepteur des androgènes
Il y a soit microdélétion de quelques paires de bases, soit insertion de nucléotides – sont, comme les macrodélétions, exceptionnelles. Sept microdélétions ont été rapportées dans la description de cas de formes complètes de résistances aux androgènes. Dans la majorité des cas, cette délétion entraîne un décalage du cadre ouvert de lecture (phase de lecture de l'enchaînement des triplets sur un brin d'ADN sans codon « stop ») avec l'apparition d'un codon « stop » prématuré. Comme pour les microdélétions, ces insertions entraînent une anomalie du cadre ouvert de lecture et l'apparition d'un codon « stop » prématuré.
L'altération de la structure de l'ARNm
Elle résulte de mutations ponctuelles dans le cadre ouvert de lecture, à la jonction exon-intron, ou plus rarement dans l'intron. Le changement d'une base au niveau de l'ADN par une autre base entraîne deux types d'altérations possibles : les anomalies de l'épissage, c'est-à-dire de la maturation de l'ARNm, et la présence d'un codon « stop » prématuré qui entraîne un transcrit plus court. Cinq anomalies de l'épissage (une délétion dans l'intron 1 et quatre mutations des sites accepteurs bordant les introns 3, 4, 6 et 7) et onze cas de codons « stop » ont été rapportés à ce jour. Dans tous les cas, l'anomalie génique a été détectée chez des patients présentant une résistance complète aux androgènes.
Les mutations substituant un acide aminé
Elles altèrent la structure primaire du récepteur d'androgène, représentent la grande majorité des anomalies moléculaires trouvées dans les syndromes de résistance complète ou partielle aux androgènes. Les substitutions existent sur toute la protéine, avec cependant quelques particularités. Le domaine N-terminal semble peu touché par les remaniements géniques, alors que le domaine de liaison de l'hormone présente la majorité des substitutions. Dans certains cas, un même acide aminé a été retrouvé muté dans plusieurs familles non apparentées. Le mécanisme moléculaire à l'origine de ces « points chauds » reste inconnu. Enfin, il est intéressant de noter que, dans certaines familles, la même substitution entraîne soit un phénotype complet, soit un phénotype partiel de pseudohermaphrodisme lié à la résistance aux androgènes. Ces observations soulignent la complexité des mécanismes induisant la différenciation sexuelle et confirment l'existence de facteurs épigénétiques, encore inconnus, dans la régulation de l'action des androgènes.
Par ailleurs, la découverte d'une mutation du récepteur des androgènes dans une famille où la résistance aux androgènes a été détectée pose la question du conseil génétique : diagnostic d'hétérozygotie des femmes d'une même famille et diagnostic anténatal d'un fœtus 46,XY qui présente 50 p. 100 de risques de porter le chromosome X atteint. Il est toutefois nécessaire de noter que, comme dans le cas d'autres pathologies liées au chromosome X, le pourcentage de mutation de novo est de l'ordre de 10 à 20 p. 100.
Autres anomalies génétiques
D'autres anomalies géniques ont été également retrouvées dans les autres formes de résistance aux androgènes. La maladie de Kennedy résulte d'une expression anormale de triplets CAG (plus de 40 CAG au lieu des 20-30 habituellement retrouvés) codant pour la glutamine au niveau du domaine de transactivation du récepteur des androgènes. Ce type d'anomalie génique, appelée mutation dynamique, est également rapporté dans la maladie de l'X fragile, la myotonie de Steinert ou la chorée de Huntington. Certaines formes de cancer du sein chez l'homme semblent être liées à des mutations siégeant dans une région particulière du domaine central de liaison de l'ADN, alors que dans le cancer de la prostate des mutations somatiques ont été retrouvées, principalement dans le domaine de liaison de l'hormone. On considère actuellement que ces mutations somatiques du récepteur des androgènes sont à l'origine du phénomène d'échappement thérapeutique observé dans le cancer de la prostate pharmacorésistant.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques DECOURT : professeur honoraire de clinique endocrinologique à la faculté de médecine de Paris, membre de l'Académie nationale de médecine
- Jean-Marc LOBACCARO : docteur de l'université de Montpellier (développement et reproduction), chercheur de l'industrie pharmaceutique
- Étienne PATIN : biologiste à l'Institut Pasteur et au musée de l'Homme
- Lluis QUINTANA-MURCI : docteur ès sciences, chargé de recherche, C.N.R.S.-Institut Pasteur
- Charles SULTAN : médecin des hôpitaux, docteur ès sciences, professeur des universités (première classe), C.H.U. Montpellier
Classification
Médias
Autres références
-
ANIMAUX MODES DE REPRODUCTION DES
- Écrit par Catherine ZILLER
- 4 448 mots
- 4 médias
La reproduction sexuée pose un problème qui lui est propre.C'est celui de la différenciation en deux sexes distincts ou sexualisation. En effet, la gamétogenèse s'effectue selon deux voies différentes. La gamétogenèse mâle produit des gamètes mâles ou spermatozoïdes ; c'est...
Voir aussi
- SEXE DÉTERMINATION DU
- ENZYMES
- TESTICULES
- TESTOSTÉRONE
- RÉCEPTEURS NUCLÉAIRES, biochimie
- PROGESTÉRONE
- MUTATIONS DYNAMIQUES ou MALADIES À EXPANSION DE TRIPLETS
- GONADOTROPHINES HYPOPHYSAIRES ou HORMONES GONADOTROPES
- FSH (Follicle Stimulating Hormone) ou HORMONE FOLLICULO-STIMULANTE
- HÉRÉDITAIRES MALADIES ou MALADIES GÉNÉTIQUES
- OVAIRE
- HORMONOTHÉRAPIE
- NOYAU CELLULAIRE
- TRANSCRIPTION, biologie moléculaire
- PSEUDOHERMAPHRODISME
- KENNEDY MALADIE DE
- SPERMATOZOÏDE
- PUBERTÉ
- HYPERFOLLICULINIE
- SPERMATOGENÈSE
- GONADES
- MÜLLER CANAL DE
- INSUFFISANCE TESTICULAIRE
- INSUFFISANCE OVARIENNE
- HIRSUTISME
- TUBES SÉMINIFÈRES
- WOLFF CANAL DE
- EUNUCHOÏDISME
- SEXUELLES HORMONES
- HYPERPLASIE SURRÉNALE CONGÉNITALE
- PHOSPHORYLATION
- RÉDUCTASES
- SERPENTS ou OPHIDIENS
- INACTIVATION DU CHROMOSOME X
- SEXE, biologie
- INSUFFISANCE ANTÉHYPOPHYSAIRE ou HYPOPITUITARISME
- CHORIO-ÉPITHÉLIOME
- GONOSOMES ou CHROMOSOMES SEXUELS ou HÉTÉROCHROMOSOMES
- AUTOSOMES
- CARYOTYPE
- DIFFÉRENCIATION SEXUELLE, biologie
- RÉSISTANCE AUX ANDROGÈNES SYNDROMES DE
- CHROMOSOMES
- OVULE
- RECOMBINAISON GÉNÉTIQUE
- RÉGULATION GÉNÉTIQUE
- EXPRESSION GÉNÉTIQUE
- RÉCEPTEURS HORMONAUX
- DÉRIVE GÉNÉTIQUE
- CHAPERONNES PROTÉINES
- BARR CORPUSCULE DE ou CORPUSCULE CHROMATINIEN
- DÉVELOPPEMENT HUMAIN
- MÉNORRAGIE
- REMANIEMENT CHROMOSOMIQUE
- INVERSION CHROMOSOMIQUE
- ARRHÉNOBLASTOME
- VIRILISATION
- AMBIGUÏTÉS SEXUELLES
- TESTICULE FÉMINISANT
- DIHYDROTESTOSTÉRONE (DHT)