SILICATES
Article modifié le
Les tectosilicates
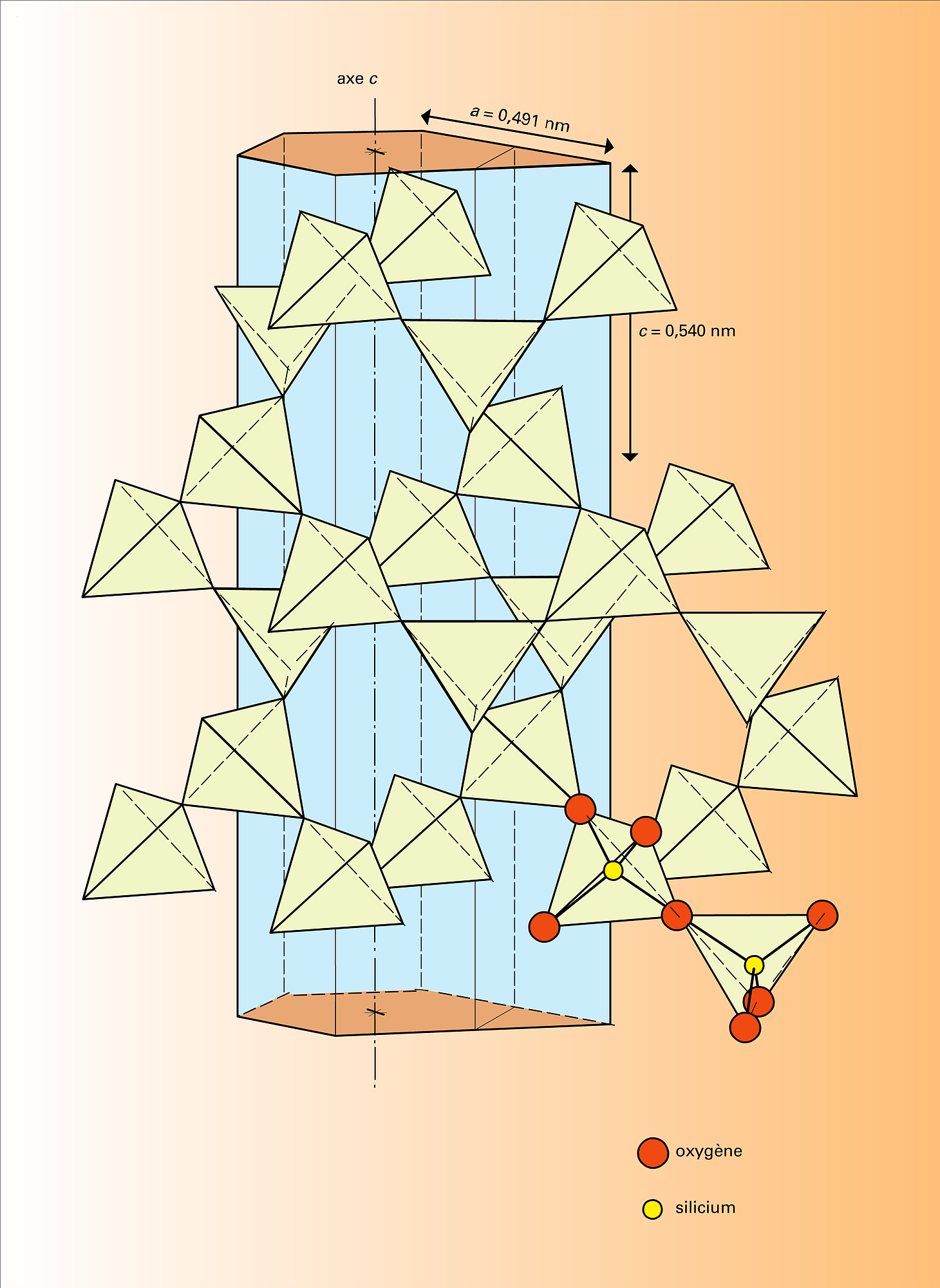
Toutes les formes de silice à l'exception de la stishovite peuvent être considérées comme des tectosilicates, car leur structure atomique est un assemblage des mêmes tétraèdres quasi réguliers SiO4 liés entre eux par leurs quatre sommets ; comme chacun des atomes d'oxygène se trouve lié à deux atomes de silicium, la composition chimique correspond à la formule SiO2. Les formes les plus importantes de silice cristallisée, des points de vue géochimique et industriel, sont le quartz, la tridymite et la cristobalite.
Dans les tectosilicates proprement dits, les tétraèdres quasi réguliers des ions oxygène, avec, en leurs centres, soit un ion silicium, soit un ion aluminium, s'associent par leurs quatre sommets pour former une charpente tridimensionnelle, de composition (Si,Al)O2, constituant un macroanion dont la charge négative est neutralisée par certains cations. L'atome d'aluminium jouant le rôle géométrique de l'atome de silicium, les tectosilicates apparaissent comme des aluminosilicates, dans lesquels les atomes Si sont au moins aussi nombreux que les atomes Al. De sorte que un ion oxygène peut être lié à deux ions Si4+ par deux valences électrostatiques (au sens de Pauling : charge de l'ion divisée par sa coordination) qui le rendent « inactif », ou à deux ions, Si4+ et Al3+, qui lui adressent une valence électrostatique 1 + 3/4. Cet oxygène « actif » est donc lié à des cations dont il reçoit 1/4 de valence électrostatique pour neutraliser sa charge − 2. Or, des ions tels que Mg2+ et Fe2+, aux centres d'octaèdres réguliers d'atomes d'oxygène (coordination 6), possèdent une valence électrostatique 2/6 = 1/3, qui est trop grande. Aussi n'entrent-ils jamais dans la composition chimique des tectosilicates. Par contre, des ions plus volumineux tels que Ca2+, Ba2+, de coordination 8, ou des ions alcalins K+, Na+, Li+, dont la valence électrostatique reste inférieure à 1/4, conviennent. On trouve cependant, dans certains tectosilicates, de petites quantités de fer sous la forme d'ions Fe3+ qui remplacent Al3+ dans les tétraèdres d'oxygène. La formule générale de tous les tectosilicates, en faisant abstraction de l'eau d'hydratation, peut s'écrire :
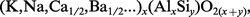
Les feldspaths
Les feldspaths sont les tectosilicates les plus importants ; ils forment plus de 60 p. 100 de l'écorce terrestre, en tant que minéraux dominants des roches éruptives et métamorphiques. Du point de vue chimique, ce sont des solutions solides du système ternaire KAlSi3O8−NaAlSi3O8−CaAl2Si2O8 qui se divisent en deux groupes : les feldspaths alcalins, contenant peu de calcium, et les feldspaths calcosodiques ou plagioclases Na1-xCaxAl1+xSi3-xO8, dont la teneur en potassium est toujours très faible.
Les propriétés cristallines et physiques des feldspaths, en particulier leur densité et leurs propriétés optiques, présentent des analogies étroites. Cependant, leurs faibles différences ne dépendent pas uniquement de la composition chimique, mais aussi de la température et des conditions de leur cristallisation en même temps que de leur histoire thermique. Aussi le polymorphisme des feldspaths a-t-il fait l'objet de très nombreuses recherches en vue d'expliquer la genèse des roches dont ces minéraux constituent la partie la plus importante. Les résultats qui ont éclairé le plus ces problèmes difficiles de physique cristalline résultent de recherches, poursuivies pendant plusieurs décennies, sur la détermination précise de la position des atomes dans le réseau des différents feldspaths grâce à la diffraction des rayons X.
Le feldspath potassique KAlSi3O8 se présente sous une forme stable à haute température, la sanidine, monoclinique, et sous une forme triclinique, le microcline, stable aux basses températures, le point d'une transformation difficile se situant vers 700 0C. L'orthose (ou orthoclase), monoclinique, qui est le nom commun du feldspath potassique, représente un état intermédiaire entre la sanidine et le microcline ; l'adulaire est une orthose qui a cristallisé, à une température voisine de 400 0C, avec un faciès particulier. Ces divers feldspaths proviennent de l'arrangement plus ou moins ordonné des ions Si et Al dont les tailles sont différentes ; comme les distances Si-O et Al-O ont respectivement pour valeur 0,161 nm et 0,175 nm, les rayons X permettent de situer ces atomes Si et Al. Aux températures élevées, les ions Si et Al sont distribués au hasard à l'intérieur des mêmes sites tétraédriques dans un désordre total (cf. feldspaths, fig. 4) ; au contraire, dans le microcline, dont la triclinicité est maximale, les atomes Si et Al occupent des sites bien définis dans un ordre parfait ; mais la cinétique de la transformation est très lente et l'on observe tous les états intermédiaires. Ce degré d'ordre peut être mesuré avec les rayons X ; il fournit une donnée précieuse pour retracer l'histoire thermique des roches qui contiennent ces feldspaths.
On retrouve les mêmes faits structuraux avec l'albite, feldspath sodique NaAlSi3O8, qui, à l'état naturel, se présente sous une forme triclinique, ordonnée quant aux Si et aux Al, stable à basse température ; chauffée, elle fournit d'abord l'analbite, triclinique, désordonnée, et, à température plus élevée, la monalbite, monoclinique. L'action hydrothermale de solutions, soit sodiques, soit potassiques, transforme facilement les feldspaths alcalins les uns dans les autres et l'on obtient toujours dans ce cas, même en opérant à des températures relativement basses (ne dépassant pas 400 0C), les formes désordonnées. Les plagioclases constituent une série continue depuis l'albite jusqu'à l'anorthite CaAl2Si2O8.
Les structures atomiques des feldspaths sont très voisines ; ces minéraux possèdent deux clivages faciles dont l'angle est droit dans les formes monocliniques (d'où l'origine du mot « orthose »), très voisin d'un angle droit (900 30′) dans le microcline ; dans les plagioclases, les clivages sont plus obliques et font un angle voisin de 940. Le baryum peut entrer dans la composition des feldspaths potassiques et l'on connaît, à l'état naturel, le feldspath BaAl2Si2O8, monoclinique : le celsian.
Les feldspaths alcalins sont généralement associés. À température élevée peuvent exister des phases homogènes (K,Na)AlSi3O8 depuis l'orthose jusqu'à l'albite ; mais, au refroidissement, deux phases se séparent, l'une riche en potassium, l'autre en sodium, et s'orientent dans des directions cristallographiques bien définies. Cette « épitaxie » est une perthite quand l'orthose domine, une antiperthite quand c'est l'albite. On trouve à l'état naturel et on reproduit au laboratoire des solutions solides d'analbite avec des fortes teneurs de potassium, qui sont des anorthoses ou anorthoclases.
Les feldspathoïdes
Les feldspathoïdes sont des tectosilicates des roches éruptives et des roches volcaniques moins riches en silice que les feldspaths. Citons la néphéline NaAlSiO4, la kalsilite et la kaliophilite, de formule voisine, la leucite KAlSi2O6, que l'on trouve dans les roches volcaniques en trapézoèdres parfaitement réguliers parce que ce minéral a cristallisé à une température supérieure à 625 0C, où il est cubique ; au-dessous de cette température, la leucite devient quadratique, et les cristaux, gardant leur forme, sont constitués par des microcristaux quadratiques maclés. On peut rapprocher de la leucite, par ses propriétés cristallochimiques et parce qu'elle peut apparaître dans les mêmes roches, l'analcime NaAlSi2O6.H2O, cubique, qui est une zéolite. Les silicates du groupe de l'outremer possèdent une charpente aluminosilicique plus ouverte que celle des feldspaths ; ces minéraux cubiques sont principalement la sodalite, de formule Na8Al6Si6O24Cl2, la noséane Na8Al6Si6O24.SO4, la haüyne (Na,Ca)8-4Al6Si6O24(SO4)2-1, la lazurite ou outremer (Na,Ca)8Al6Si6O24(SO4,S,Cl)2 ; le lapis-lazuli, roche constituée presque exclusivement d'outremer, d'une belle couleur bleue, est exploité, depuis des temps immémoriaux, dans les mêmes gisements de l'Hindou Kouch, en Afghanistan, pour la fabrication d'objets d'ornement et, pendant longtemps, fut utilisé comme pigment de peinture. De ce groupe se rapprochent la cancrinite Na6Ca(Al6Si6O24)CO3.3H20 et les scapolites ou wernérites, solutions solides de la marialite Na4Al3Si9O24Cl et de la méionite Ca4Al6Si6O24(SO4,CO3), rencontrées dans des roches métamorphiques ou métasomatiques riches en calcium.
Les zéolites
Les zéolites sont des tectosilicates hydratés dont la charpente aluminosilicique (Al,Si)xO2x présente de grandes « cages », communiquant par des « tunnels » plus ou moins larges, où se logent les cations et les molécules d'eau. La structure atomique de ces composés, dont la formule générale peut s'écrire :

L'eau zéolitique. Les zéolites perdent leur eau, dans une atmosphère sèche ou quand on les chauffe, et la récupèrent réversiblement tout en demeurant parfaitement homogènes. On les a comparées à des « éponges » dont la teneur en eau est fonction de la température et de la tension de la vapeur d'eau. Une zéolite déshydratée, dite activée, réabsorbe son eau avec un grand dégagement de chaleur ; mais l'eau peut être remplacée par l'ammoniac, le gaz carbonique, l'hydrogène sulfuré, des molécules organiques, pourvu que leurs formes et leurs dimensions leur permettent de circuler dans les tunnels et d'occuper les cages du réseau cristallin.
La facilité d'échange des cations est une propriété connue depuis longtemps. Au contact de solutions de différents sels dès la température ordinaire, il y a échange des cations Na+, K+, Ca2+, Ba2+. Cette propriété de « permutite » reçoit différents usages, par exemple pour adoucir les eaux. Cet échange des cations s'observe aussi dans les feldspaths et les feldspathoïdes, mais, comme la charpente aluminosilicique de ces tectosilicates est plus compacte, ainsi que l'indiquent les densités (feldspaths, entre 2,6 et 2,7 ; feldspathoïdes, 2,3 et 2,5 ; zéolites, 2,0 et 2,3), il faut opérer dans des conditions hydrothermales, c'est-à-dire à des températures et à des pressions de vapeur d'eau élevées. Les zéolites se comportent en véritables « tamis moléculaires », capables de séparer des cations ou des molécules de dimensions différentes.
Parmi les principales applications industrielles, on peut citer le séchage des gaz et des liquides organiques renfermant des traces d'eau, la séparation des différents carbures dans l'industrie pétrolière, enfin la purification de produits organiques. On utilise généralement, pour ces applications, des zéolites synthétiques.
Les zéolites naturelles comprennent un grand nombre d'espèces que l'on classe en plusieurs groupes d'après les analogies cristallographiques :
– les zéolites fibreuses se présentent en cristaux allongés, avec deux clivages faisant un angle voisin de 900. Ce sont : le mésotype (ou natrolite) Na2Al2Si3O10.2H2O ; le mésolite Na2Ca2(Al2Si3O10)3.8H2O ; la thomsonite NaCa2Al5Si5O20.6H2O ; la scolécite CaAl2Si3O10.3H2O ; enfin l'édingtonite BaAl2Si3O10.4H2O.
– Les zéolites lamellaires, avec un clivage parfait, comprennent : la heulandite et la clinoptilolite, qui lui est apparentée, de formule (Ca,Na2)Al2Si7O18.6H2O ; la stilbite ou desmine, très voisine chimiquement ; l'épistilbite CaAl2Si6O16.5H2O ; la brewstérite (Ca,Ba,Sr)Al2Si6O16.5H2O.
– Dans le groupe de la gismondine (orthorhombique) CaAl2Si2O8.4H2O, on trouve la laumontite CaAl2Si4O12.4H2O et la mordénite (Ca,Na2)Al2Si10O24.7H2O.
– Le groupe de la phillipsite (monoclinique) KCaAl3Si5O16.6H2O est représenté principalement l'harmotome, de formule BaAl2Si6O12.6H2O.
– Le groupe de la chabasie (rhomboédrique) CaAl2Si4O12.6H2O comprend la gmélinite et la lévyne, avec la même formule chimique.
– La faujasite Na2CaAl4Si8O24.16H2O et l'analcime NaAlSi2O6.H2O sont toutes deux cubiques.
Parmi les zéolites artificielles, certaines sont des faujasites ou des phillipsites.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean WYART : membre de l'Académie des sciences, professeur honoraire de l'université de Paris-VI-Pierre-et-Marie-Curie
Classification
Médias
Autres références
-
AMÉTHYSTE
- Écrit par Yves GAUTIER
- 2 340 mots
- 1 média
Tectosilicate, l'améthyste est la variété gemme la plus prisée des nombreuses espèces du groupe du quartz auquel elle appartient. À l'état naturel, elle se reconnaît aisément par ses cristaux prismatiques pseudohexagonaux de couleur violacée, terminés à chaque extrémité par un rhomboèdre. La couleur...
-
AMIANTE ou ASBESTE
- Écrit par Encyclopædia Universalis , Laurence FOLLÉA et Henri PÉZERAT
- 3 490 mots
L'amiante (ou asbeste) est un minéral fibreux de la famille des silicates, formé naturellement au cours du métamorphisme des roches. On distingue deux variétés principales d'amiante : la serpentine, représentée notamment par la chrysotile, ou « amiante blanc » (95 p. 100 de la production... -
AMPHIBOLES & PYROXÈNES
- Écrit par Jean-Paul CARRON
- 3 857 mots
- 8 médias
Les amphiboles et les pyroxènes, deux groupes de minéraux parfois réunis sous l'appellation de « pyriboles », sont des constituants essentiels des roches métamorphiques et des roches magmatiques. Ils appartiennent à la catégorie des inosilicates ou silicates en chaîne ; les différences...
-
ANDALOUSITE
- Écrit par Michel GIBERT
- 282 mots
Avec la sillimanite et le disthène, l'andalousite (qui tire son nom de l'Andalousie, province espagnole où ce minéral fut décrit) fait partie du groupe des silicates d'alumine anhydres.
C'est un subnésosilicate : la structure cristalline montre des chaînes d'octaèdres AlO...
- Afficher les 36 références
Voir aussi
- LAPIS-LAZULI
- MINÉRAUX
- TÉTRAÈDRE, stéréochimie
- NÉSOSILICATES
- SMECTITES
- PHYLLOSILICATES
- FELDSPATHOÏDES
- INOSILICATES
- KAOLINITE
- GOLDSCHMIDT VICTOR MORDECHAÏ (1853-1933)
- CYCLOSILICATES
- HÉTÉROSILICATES
- TECTOSILICATES
- SOROSILICATES
- SILICIQUE ACIDE
- GLAUCONIE
- ARGILEUX MINÉRAUX
- FELDSPATHS ALCALINS
- ALLANITE ou ORTHITE
- ANTIGORITE
- CHRYSOTILE
- CLINOZOÏSITE
- ZOÏSITE
- HUMITES
- HALLOYSITE
- VERMICULITE