SILICE
Article modifié le
Le dioxyde de silicium ou silice occupe, parmi les oxydes, une place exceptionnelle ; en effet, par ses propriétés cristallochimiques, par ses modes de genèse, par son importance pétrographique, il s'apparente étroitement aux silicates. Dans la quasi-totalité de ses formes, il apparaît comme le modèle le plus simple des tectosilicates : une charpente tridimensionnelle faite de tétraèdres SiO4 liés les uns aux autres par leurs sommets, chaque atome d'oxygène étant commun à deux tétraèdres, d'où la formule globale SiO2. On connaît actuellement huit formes cristallisées de silice anhydre : le quartz, la tridymite, la cristobalite, la coésite, la kéatite, la stishovite, la mélanophlogite, la silice fibreuse W. À l'état amorphe, l'oxyde de silicium existe sous la forme de verre de silice anhydre et sous celle de silice colloïdale hydratée. La plupart de ces différentes silices – quartz, tridymite, cristobalite, coésite, stishovite, mélanophlogite, lechateliérite (verre de silice) et opales, silices hydratées plus ou moins amorphes – sont présentes dans la nature. Le quartz, et ses nombreuses variétés, est de très loin l'espèce la plus importante ; il est, avec les silicates qu'il accompagne fréquemment, l'un des minéraux majeurs de beaucoup de roches – en particulier des roches éruptives, dans la classification desquelles interviennent l'excès, la saturation ou le déficit en silice. Les nombreuses applications industrielles (optique, électronique, production de matériaux réfractaires, etc.) que connaît cette famille minérale accroissent encore l'intérêt des études qu'ont suscitées des propriétés et un rôle géochimique originaux.
Physico-chimie
Il existe des relations étroites entre les structures des diverses silices. Toutes les formes sauf une, la stishovite, présentent les mêmes tétraèdres SiO4 s'associant par leurs sommets comme dans les tectosilicates (cf. silicates, fig. 1). Cependant, les modes d'association varient d'une espèce à l'autre, ce qui entraîne des différences dans les densités et les indices moyens de réfraction.
Transformations polymorphiques
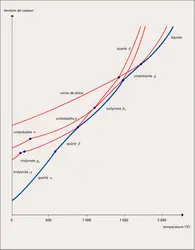
Les trois principales formes de silice – quartz, tridymite, cristobalite – correspondent chacune à des conditions d'équilibre bien définies. Leurs domaines de stabilité thermodynamique à la pression ordinaire ont été déterminés par C. N. Fenner en 1913. À la température ordinaire, le quartz, qui est stable, la tridymite et la cristobalite, qui sont métastables, sont des formes de basse température (dites B.T. ou α) ; elles subissent, quand on les chauffe, des transformations en formes de haute température (H.T. ou β) ; ces transformations, rapides et réversibles, sont appelées paramorphiques ou de déplacement, car elles comportent de faibles déplacements des atomes et de légères modifications des propriétés physiques, alors que les transformations mutuelles, dites non paramorphiques ou reconstructives, de ces trois formes de silice, dont les structures atomiques et les propriétés physiques diffèrent profondément, sont lentes, difficiles et nécessitent le plus souvent l'action d'un minéralisateur qui en augmente considérablement la vitesse. L'importance économique des minéralisateurs (sels alcalins ou alcalino-terreux principalement) peut être considérable, par exemple, dans l'industrie des réfractaires, où l'on utilise des briques de silice ; la matière première est le quartz sous la forme de grès ou de quartzites et des silex qu'il s'agit de transformer, au meilleur marché, en un mélange de tridymite et de cristobalite.
L'influence de la pression sur les transformations paramorphiques et non paramorphiques de la silice a été étudiée, en particulier, par H. S. Yoder (1950), O. F. Tuttle et N. L. Bowen (1958). La température de la transition quartz de basse température-quartz de haute température est élevée d'environ 1 0C pour une augmentation de la pression de 4 × 106 pascals. Le diagramme température-pression montre également que la tridymite et la cristobalite ne peuvent se former respectivement au-dessus de 3 × 108 et de 5 × 108 pascals ce qui pourrait expliquer leur extrême rareté dans les roches plutoniques.
Fusion, dévitrification, vaporisation
La température de fusion (équilibre solide-liquide) des silices cristallisées est difficile à déterminer par les méthodes classiques. Généralement, on détecte la fusion par l'identification (au microscope polarisant) du verre obtenu par un refroidissement rapide. La cristobalite, forme stable de haute température, fond à 1 713 0C, avec une chaleur latente de fusion de 7 670 J . mol-1. Les points de fusion, à la pression ordinaire, du quartz et de la tridymite, qui sont métastables à haute température, sont mal définis. Le quartz pur commence à fondre vers 1 500 0C, la tridymite vers 1 670 0C. À la température ordinaire, la silice vitreuse est métastable. Maintenue au-dessus de 1 000 0C, elle se dévitrifie d'autant plus rapidement qu'elle est plus divisée et que la température est plus élevée. C'est la cristobalite qui cristallise normalement, en trois étapes : nucléation, cristobalite plus ou moins bien cristallisée, cristobalite bien ordonnée. L'obtention de tridymite ou de quartz requiert l'intervention de minéralisateurs ; par exemple, avec NaCl, et KCl, et en présence d'air, la cristallisation s'effectue entre 800 et 1 000 0C pour la tridymite, entre 700 et 750 0C pour le quartz (il se forme d'abord la cristobalite vers 780 0C) ; avec d'autres minéralisateurs (NaF et KF, Na2O, CaO, etc.), les températures seront sensiblement différentes.
La volatilisation de la silice, signalée depuis longtemps (Gaudin, Moissan...), s'opère autour de 2 700 0C avec une tension de vapeur de 7 × 104 Pa (Ruff et al.).
Réactions chimiques
Les propriétés chimiques des différentes silices sont très voisines, mais les réactions sont d'autant plus faciles que le matériau est plus divisé, léger et hydraté.
La silice est attaquée par l'acide fluorhydrique HF pour donner l'acide fluosilicique H2SiF6 ; en milieu déshydratant (en présence de H2SO4, par exemple), il se dégage du tétrafluorure de silicium SiF4. Cette attaque est utilisée dans la gravure sur verre.
On peut considérer SiO2 comme un anhydride, qui est donc attaquée par les bases anhydres (et les carbonates alcalins et alcalino-terreux), plus facilement à l'état fondu qu'en solution, pour donner des silicates. La fusion alcaline avec le carbonate de sodium est pratiquée couramment au début des analyses de produits siliciques.
La silice réagit avec de nombreux sels. Les réactions avec les silicates, particulièrement importantes au sein de l'écorce terrestre, s'effectuent à des températures généralement inférieures à 1 000 0C, mais sous des pressions pouvant atteindre plusieurs milliers de kilopascals et en présence de H2O et de constituants volatils (HCl, CO2...), lors du métamorphisme et de l'anatexie (cf. roches - Anatexie, métamorphisme).
Le système SiO2-H2O
Le rôle minéralisateur de l'eau, soupçonné très tôt par les minéralogistes observant des inclusions aqueuses dans les cristaux de quartz et l'association à ce minéral de formes hydratées telles que l'opale, a été mis en évidence par les expériences de cristallisation et de transformation polymorphique par voie hydrothermale effectuées, dès le milieu du xixe siècle, par Daubrée, Friedel... La figureb représente le diagramme température-pression d'eau des principales formes de silice.
Il est bien établi maintenant que la silice se dissout dans l'eau sous la forme de la molécule Si(OH)4, acide monosilicique ou orthosilicique, peu dissocié (plus faible que l'acide carbonique), selon la réaction de dépolymérisation :

La teneur en Si(OH)4 de la solution croît en fonction du temps, pour atteindre une valeur limite qui correspond au taux de saturation ; les vitesses de dissolution sont beaucoup plus faibles pour les formes cristallisées que pour la silice amorphe et dépendent en outre de la granulométrie du matériau. La solubilité, qui est de 0,140 g/l (140 ppm) à 25 0C, dépend peu du pH tant que celui-ci demeure inférieur à 9 ; au-dessus de cette valeur, la molécule Si(OH)4 se dissocie en ions tels que [SiO(OH)3]-, [SiO2(OH)2)2- et H+, et l'équilibre de dépolymérisation est fortement déplacé : la solubilité s'accroît de façon exponentielle ( b). Lorsque le titre pondéral en silice monomoléculaire dépasse la saturation pour un pH donné, la solution devient instable : il se forme des composés condensés (dans l'ordre de condensation déshydratante, acides oligosiliciques, sols, gels, polymères solides), jusqu'à ce que la teneur en Si(OH)4 retombe à 140 ppm. Cette évolution est réversible : par dilution du liquide, ou par relèvement de son pH, on provoque l'hydrolyse des composés condensés avec retour à l'état monosilicique.
Dans les eaux naturelles, la teneur en silice – essentiellement libérée par l'hydrolyse des silicates – est très inférieure au taux de saturation ; elle varie entre 1 et 35 ppm. Quand la température s'élève, la solubilité de la silice augmente ; pour le quartz, elle atteint 440 ppm à 100 0C, 700 ppm à 330 0C, pour décroître ensuite brusquement. Dans l'eau à l'état supercritique, elle croît régulièrement avec la pression – elle dépasse 20 p. 100 à 500 0C et 108 pascals – et augmente également si l'eau contient de petites quantités de sels alcalins.
Les réactions de la silice avec d'autres ions en solution (Al3+, Mg2+...) peuvent donner naissance à des gels mixtes (par exemple, allophanes) et, dans certaines conditions, à des silicates de néoformation comme ceux des argiles.
Effets physiologiques
Les recherches entreprises sur les pneumoconioses (cf. appareilrespiratoire) ont montré que les poussières de silice inhalées, à la différence de celles de charbon, par exemple, sont toxiques et que leur effet fibrosant, caractéristique de la silicose, serait plus sensible avec les formes cristallisées qu'avec la silice amorphe.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Maurice LELUBRE : professeur émérite à l'université de Toulouse-III-Paul-Sabatier
- Jean WYART : membre de l'Académie des sciences, professeur honoraire de l'université de Paris-VI-Pierre-et-Marie-Curie
Classification
Médias
Autres références
-
ACIDES ROCHES
- Écrit par Jean-Paul CARRON
- 426 mots
En pétrographie, on qualifie de « roches acides » celles qui contiennent plus de 65 p. 100 en poids du constituant SiO2 (la silice). Comme les minéraux les plus siliceux — à l'exception bien entendu du quartz — sont les feldspaths alcalins, pour lesquels la teneur en SiO2 est précisément...
-
AGATE
- Écrit par Yves GAUTIER
- 710 mots
- 1 média
Dioxydes de silicium, les agates appartiennent au groupe des quartz microcristallins, comme les calcédoines et les jaspes. Elles se distinguent facilement des calcédoines car elles présentent une coloration zonée concentrique, sinueuse ou bréchique. Elles peuvent être cependant confondues avec l'onyx...
-
BÉTON
- Écrit par Jean-Michel TORRENTI
- 8 164 mots
- 1 média
-
CALCÉDOINE
- Écrit par Yves GAUTIER
- 794 mots
- 3 médias
- Afficher les 28 références
Voir aussi