SILICIUM
Dérivés organiques
Généralités
En raison de sa structure électronique 1s2, 2s2, 2p6, 3s2, 3p2, 3d0, le silicium se situe juste sous le carbone dans la classification périodique. Il est normalement tétravalent, mais la spécificité du silicium entraîne des différences importantes entre la chimie organosilicique et la chimie organique. Ainsi :
– Le silicium est nettement plus volumineux que le carbone (rayons atomiques en nanomètres [nm] : C, 0,091 ; Si, 0,132), ce qui entraîne que les liaisons impliquant le silicium sont comparativement plus longues que celles qui impliquent le carbone. Exemples (nm) : C−H, 0,109 ; Si−H, 0,148 ; C−C, 0,154 ; C−Si, 0,189 ; Si−Si, 0,234 ; C−O, 0,141 ; Si−O, 0,163, les valeurs pouvant légèrement varier avec la nature des produits considérés. De ce fait, le recouvrement π est faible et, alors que l'état d'hybridation sp2 ou sp est commun en chimie du carbone, les dérivés possédant un silicium triplement lié n'existent pas, et les composés à silicium doublement lié, stables à température ambiante, sont très peu nombreux et nécessitent une protection de la double liaison par des groupes encombrants. Il existe quelques composés à double liaison Si=C, Si=N, Si=Si, Si=P... mais pas de double liaison Si=O. Notons, dans le domaine des basses valences, la possibilité de formation des silylènes 〉 Si :.
– Le silicium possède des orbitales vacantes 3d : les orbitales dxy, dxz, dyz favorables à l'établissement de liaisons π déjà évoquées et les orbitales d(x2−y2) et surtout dz2 favorisant l'établissement de liaisons σ et autorisant la penta- et l'hexacoordination de l'atome de silicium. Le silicium n'est plus alors tétraédrique, mais la structure est de type bipyramide trigonale pour les composés pentacoordinés, par exemple SiCl4,N(C2H5)3 ou les silatranes aux propriétés biologiques importantes, ou de type octaédrique pour les composés hexacoordinés, par exemple K2SiF6 ou SiF4,2N(CH3)3. Les orbitales 3d du silicium ont été invoquées pour expliquer la planéité de l'azote lorsqu'il est lié à trois atomes de silicium (interaction [p→d]π), pour contribuer à renforcer l'énergie de la liaison Si−N, mais aussi Si−O, ou encore pour interpréter la grande stabilisation des carbanions de type (CH3)3SiC− 〈. Diverses considérations tendent à expliquer cette stabilité par une interaction de type (p→σ*)π, qui reste encore discutée, où le doublet libre du carbanion est délocalisé dans l'orbitale antiliante de la liaison Si−C. Cependant, la stabilisation d'une charge négative en α du silicium est à l'origine d'une réaction d'oléfination de dérivés carbonylés (transformation de 〉 C=O en 〉 C=C 〈) très attractive. La mise en jeu des orbitales 3d accroît donc les potentialités de la chimie organosilicique par rapport à celles de la chimie organique.
– Le silicium est plus électropositif que le carbone (électronégativités respectives : Si, 1,8 ; C, 2,5 ; H, 2,1). Cela conduit à des énergies de liaison élevées du silicium avec les éléments très électronégatifs : 549 kJ ( mol−1 pour Si−O dans les enchaînements Si−O−Si et de 600 à 690 kJ ( mol−1 pour Si−F selon les composés, ce qui donne à l'anion F− des potentialités catalytiques en série organosilicique. Le silicium, de ce fait, est sensible aux attaques nucléophiles, la substitution s'effectuant fréquemment avec une stéréospécificité élevée. Cela entraîne que la plupart des liaisons Si−Σ, sauf, le plus souvent, Si−C, soient aisément hydrolysables (Σ = Cl, Br, I, OR, NR2, OCOR, etc. – R = groupement carboné – et même Si−H en milieu basique). La réaction se termine souvent par la formation de liaisons Si−O−Si expliquant qu'à l'état naturel le silicium se trouve à l'état oxydé :[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques DUNOGUÈS : directeur de recherche au C.N.R.S., directeur du laboratoire de chimie organique et organométallique de l'université Bordeaux-I
- Michel POUCHARD : docteur ès sciences, professeur de chimie à l'université de Bordeaux-I, membre de l'Institut
Classification
Média
Autres références
-
DÉTECTEURS DE PARTICULES
- Écrit par Pierre BAREYRE , Jean-Pierre BATON , Georges CHARPAK , Monique NEVEU et Bernard PIRE
- 10 981 mots
- 12 médias
-
ACIER - Technologie
- Écrit par Louis COLOMBIER , Gérard FESSIER , Guy HENRY et Joëlle PONTET
- 14 178 mots
- 10 médias
Lesilicium se rencontre dans tous les aciers, avec de faibles teneurs, de l'ordre de 0,2 à 0,5 p. 100 : il est alors utilisé comme désoxydant. Il intervient parfois comme élément d'alliage avec de plus fortes teneurs, soit pour améliorer la limite élastique, soit pour accroître la résistance à l'oxydation,... -
CIRCUITS INTÉGRÉS
- Écrit par Frédéric PÉTROT et Franck WAJSBÜRT
- 8 998 mots
- 20 médias
...semi-conducteur – la conductivité électrique d'un semi-conducteur est intermédiaire entre celles des métaux (bons conducteurs) et celle des isolants –, le plus souvent du silicium, sur lequel sont implantés les composants électroniques élémentaires (transistors, résistances, capacités, inductances) et... -
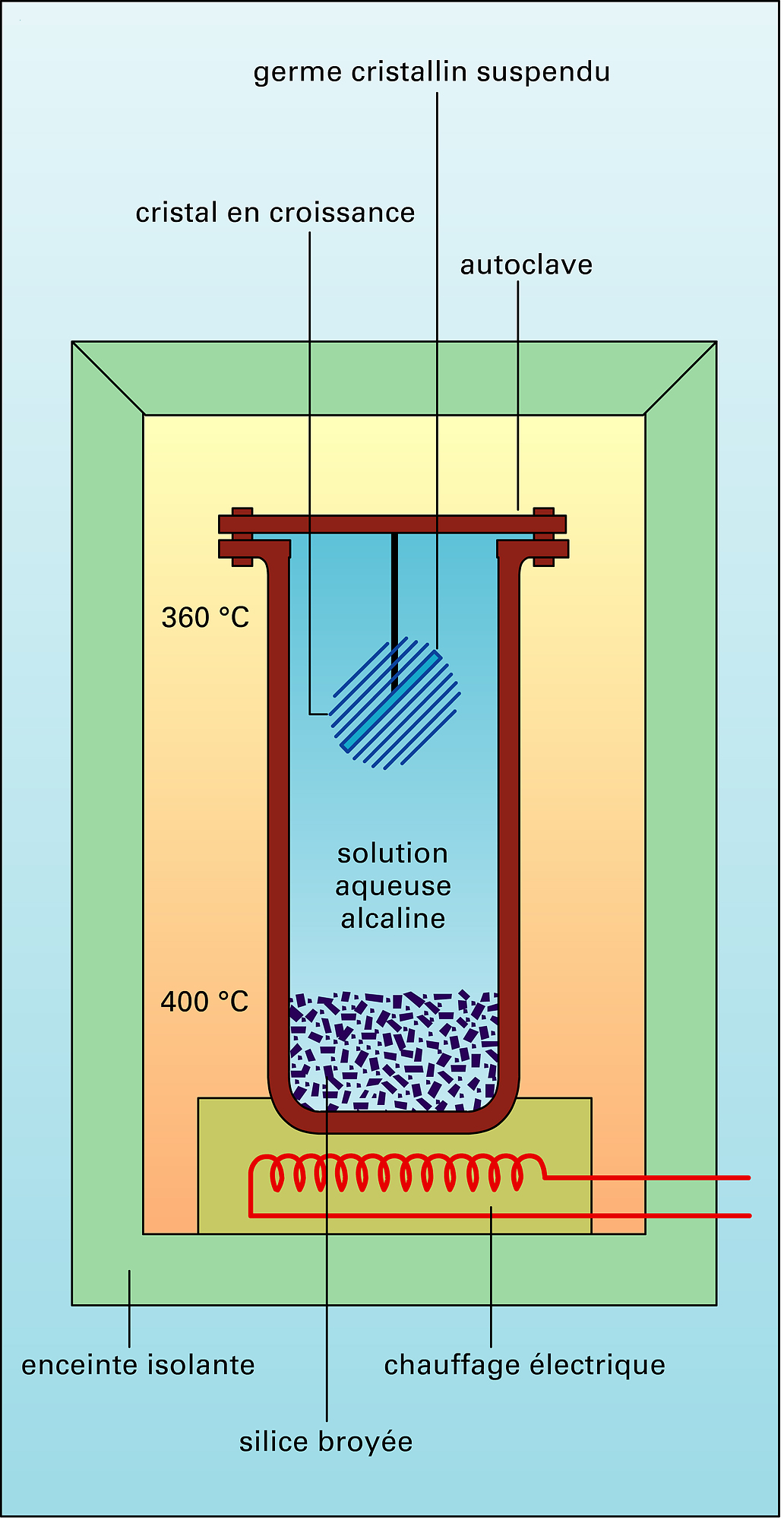
CRISTAUX - Synthèse des cristaux
- Écrit par Yves GAUTIER
- 6 278 mots
- 2 médias
Le germanium et, surtout, lesilicium sont les principaux semiconducteurs de synthèse. En 2000, la production mondiale de silicium avoisinait les 6 000 tonnes ; chiffre significatif qui fait parfois appeler notre époque, depuis l'utilisation de cet élément comme diode dans les postes à galène jusqu'aux... - Afficher les 25 références