SODIUM
Élaboration et usages du métal
Extraction du métal
C'est par électrolyse de l'hydroxyde NaOH fondu que Davy isola l'élément pour la première fois en Angleterre, en 1807, quelques jours après le potassium. Joseph-Louis Gay-Lussac et Louis-Jacques Thenard, en France, l'obtenaient à leur tour l'année suivante, en réduisant l'hydroxyde par le fer au rouge.
La première fabrication industrielle du sodium est liée à l'élaboration de l'aluminium par le procédé Sainte-Claire Deville (1854) qui l'utilisait pour réduire le chlorure d'aluminium. Il était alors préparé en réduisant par le carbone, ou par une fonte carbonée, le carbonate ou l'hydroxyde de sodium (procédés Deville en France, Castner aux États-Unis).
À la fin du xixe siècle, le développement de l'aluminium électrolytique (procédé Hall-Héroult) risquait de compromettre le marché du sodium : Castner lui trouva de nouveaux débouchés en proposant la synthèse à partir du métal des amidure, cyanure et peroxyde de sodium. Simultanément, il montait à Niagara Falls la première unité de production de sodium par électrolyse ignée de son hydroxyde (1895).
Dans les cellules Castner, la température modérée de fusion de l'hydroxyde (320 0C) simplifiait les problèmes technologiques, mais le rendement en courant était relativement faible (50 p. 100) par suite de réactions secondaires tendant à réoxyder le sodium formé (diffusion de l'eau formée à l'anode).
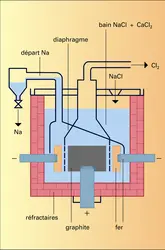
L'électrolyse ignée du chlorure de sodium autorisait un meilleur rendement : le procédé Downs remplaça le procédé Castner et fut utilisé par Du Pont de Nemours à Niagara Falls dès 1921. La température de fusion du chlorure de sodium étant très élevée (800 0C), on utilise pratiquement un mélange de chlorure de sodium (28 p. 100 en masse), de chlorure de calcium (26 p. 100) et de chlorure de baryum (46 p. 100) qui permet d'abaisser la température du bain à 600 0C environ. L'anode est en graphite, la cathode en fer. Le sodium qui se dépose contient moins de 1 p. 100 de calcium, que l'on élimine jusqu'à la teneur de 0,05 p. 100 par filtration ou décantation à 115 0C. Le calcium est l'impureté principale du sodium marchand.
Une cellule Downs comprend 4 anodes cylindriques en graphite entourées par 4 cathodes en acier séparées par une fine toile d'acier, contient environ 8 t de sels, fonctionne sous 7 volts avec une intensité de 50 000 ampères. Le rendement en courant atteint 80 à 90 p. 100 ; la consommation énergétique est de 10 kWh/kg de sodium.
La manipulation du métal, qui doit se faire sous azote sec, demande de grandes précautions du fait des dangers d'explosion ou d'incendie en présence d'eau. Son transport est réglementé. Il est livré en bâtonnets dans de l'huile, en lingots, en fûts ou citernes d'acier (90 p. 100) d'où on l'extrait par fusion. Il est également vendu sous forme de dispersion dans du xylène ou du kérosène.
Utilisations du métal
La production mondiale annuelle de sodium est passée de 25 000 t en 1930 à 140 000 t en 1952. Elle était de 202 000 t en 1972, dont 13 000 t pour la France. En 1989, la production mondiale était de 110 000 t.
En tonnage, les principales utilisations du sodium sont la fabrication du plomb tétraéthyle en diminution à cause du développement de l'essence sans plomb, de métaux tels que le titane, la synthèse organique et les circuits d'échange des centrales surrégénératrices. Les utilisations métallurgiques du métal ne représentent qu'un tonnage beaucoup plus faible (fonderie, alliage, etc.).
Synthèse organique
Le plomb tétraéthyle, antidétonant employé pour améliorer l'indice d'octane des carburants, représente une production de 120 000 t dans le monde et est obtenu par l'action[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Luc AUFFRET : ingénieur, directeur du marketing de Métaux spéciaux S.A.
- Albert HÉROLD : professeur à l'Institut, université de Paris-I
- André METROT : docteur ès sciences, maître assistant à l'Institut national polytechnique de Nancy
- Bernard PIRE : directeur de recherche émérite au CNRS, centre de physique théorique de l'École polytechnique, Palaiseau
Classification
Médias
Autres références
-
BOROPHÈNE
- Écrit par Bernard PIRE
- 991 mots
- 1 média
...propriétés, et sans doute à de nombreux développements technologiques. Une première application possible du borophène pourrait concerner les piles à base de sodium. En effet, le développement de ces piles – qui bénéficieraient par rapport à celles au lithium du caractère abondant et bon marché de l’élément... -
GLUTAMATE DE SODIUM
- Écrit par Geneviève DI COSTANZO
- 163 mots
Sel monosodique monohydraté de l'acide L(+) glutamique. Il augmente la saveur de nombreux aliments, les hydrolysats protéiques entre autres. Cette propriété, découverte en 1908 par le Japonais Ikeda Kikunae (1864-1936), le fait employer depuis lors comme arôme, en particulier dans des préparations...
-
MÉTAUX - Métaux alcalins
- Écrit par Jean PERROTEY
- 3 023 mots
- 5 médias
-
NUCLÉAIRE - Réacteurs nucléaires
- Écrit par Jean BUSSAC , Frank CARRÉ , Robert DAUTRAY , Encyclopædia Universalis , Jules HOROWITZ et Jean TEILLAC
- 11 244 mots
- 10 médias
...) et l' hélium sous pression. Parmi les liquides, l' eau ordinaire et l' eau lourde, qui sont aussi des modérateurs, ont la faveur des réacteurs à neutrons thermiques. Les réacteurs à neutrons rapides, qui excluent l'emploi de noyaux légers, ont utilisé des métaux fondus tels que le sodium. - Afficher les 11 références