SPECTROMÉTRIE DE MASSE
Article modifié le
La spectrométrie de masse est une technique d'analyse de la matière en fonction de la masse de ses constituants : particules subatomiques, atomes, molécules, macromolécules biologiques ou non, agrégats, etc. Elle offre trois fonctions principales : la séparation des constituants atomiques ou moléculaires, la mesure de leur abondance relative et la mesure précise des masses atomiques ou moléculaires. Contrairement à ce qui se passe à l'échelle macroscopique, où la gravitation sert à déterminer la masse des objets, à l'échelle atomique, c'est la masse inertielle qui est déterminée à travers un processus dynamique.
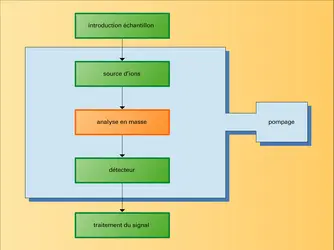
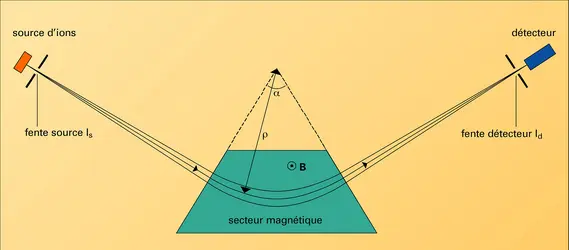
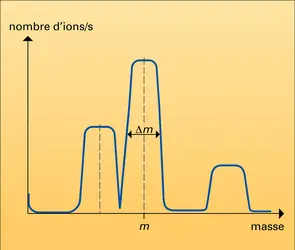
La matière à analyser est injectée, à l'aide d'un système d'introduction, dans le vide poussé de l'appareil où la source d'ions la transforme en particules électriquement chargées : les ions. Ces derniers sont analysés en masse, à l'aide d'un système analyseur qui met en jeu des combinaisons de champs électromagnétiques. Les ions transmis par le dispositif sont détectés, comptés, voire identifiés, à l'aide d'un détecteur. Un ordinateur pilote l'appareil, effectue l'acquisition des données réduites sous forme de spectres de masse qu'il permet d'analyser. Les performances d'un spectromètre de masse se caractérisent par sa limite en masse – la masse la plus élevée qu'il est capable d'analyser –, son pouvoir de résolution – son aptitude à séparer des ions de masses voisines – et sa sensibilité – la plus petite quantité de matière qu'il peut détecter (≤10—15 g). Lorsqu'il s'agit de mesurer la masse atomique ou moléculaire, il est caractérisé par sa justesse.
Historique
Apparue au début du xxe siècle, la spectrométrie de masse a apporté des éléments clés pour la compréhension du noyau atomique. Elle est issue de la découverte, par Eugen Goldstein en 1886, des rayons canaux dus aux ions positifs et de leur analyse par un champ magnétique, par Wilhelm Wien en 1898. En 1912, Joseph John Thomson obtient des spectres de masses de plusieurs composés gazeux : N2, O2, CO, CO2, etc. Il met en évidence les ions négatifs et les ions multichargés. L'année suivante, il découvre les isotopes A = 20 et A = 22 du néon. Les innovations qui suivent tentent principalement d'augmenter la sensibilité du dispositif. En 1918, A. J. Dempster construit un spectromètre à focalisation en direction. L'année suivante, Francis William Aston introduit le tri des ions en fonction de leur vitesse, ce qui lui permet de déterminer les abondances isotopiques du néon et de mettre en évidence les écarts entre les masses atomiques réelles et les nombres entiers. En 1932, K. T. Bainbridge, en associant au dispositif un filtre de vitesse de Wien, vérifie expérimentalement l'équivalence entre masse et énergie. Il propose alors la double focalisation en direction et en vitesse, principe qui sera mis en œuvre par E. B. Jordan, J. M. Mattauch et L. F. Herzog. En 1936, F. M. Penning propose de combiner un champ électrique et un champ magnétique pour piéger les ions dans un très faible volume : c'est le piège de Penning. En 1940, A. O. Nier perfectionne la source d'ions à impact électronique. Ensuite, en 1948, A. E. Cameron invente le spectromètre de masse à temps de vol. Puis, entre 1953 et 1960, W. Paul et H. S. Steinwedel mettent au point l'analyseur quadripolaire, puis le piège ionique quadripolaire qui diffère de celui de Penning par l'absence de champ magnétique. Le piège quadripolaire aura un tel retentissement en physique fondamentale que le prix Nobel sera attribué en 1989 à W. Paul et à H. Dehmelt. Pendant les années 1960, L. G. Smith met au point le spectromètre de masse à radiofréquence. Pour ce qui est des applications, depuis 1950, les techniques d'ionisation se diversifient de façon à s'adapter à la diversité des échantillons à analyser, particulièrement pour la chimie organique. Cette technique d'analyse bénéficie alors du couplage avec un chromatographe en phase gazeuse puis liquide. Les progrès de l'informatique ont permis l'automatisation des réglages de l'appareil ainsi que la mise en œuvre des analyseurs à quadripôle et des pièges ioniques dans de nombreuses applications de la spectrométrie de masse.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Michel de SAINT SIMON : directeur de recherche au C.N.R.S., centre de spectrométrie nucléaire et de spectrométrie de masse (Institut national de physique nucléaire et de physique des particules)
Classification
Médias
Autres références
-
ÂGE DE LA TERRE
- Écrit par Pascal RICHET
- 5 145 mots
- 5 médias
...instrumentaux furent cependant nécessaires. Il était en effet impossible de mesurer précisément des abondances isotopiques par des analyses chimiques. Ce fut le spectromètre de masse qui permit de le faire en séparant les isotopes comme un prisme décompose la lumière. Descendant des tubes cathodiques... -
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES et Rémi JULLIEN
- 1 616 mots
- 7 médias
...gazeux (ou accélérés, s'ils sont chargés) et dirigés vers une enceinte où on les étudie « en vol ». Parmi les nombreuses méthodes physiques utilisées, la spectrométrie de masse est la plus importante. Elle permet en effet de classer les agrégats selon le nombre N d'atomes ou de molécules qu'ils contiennent.... -
ALCALOÏDES
- Écrit par Jacques E. POISSON
- 5 689 mots
- 5 médias
...irremplaçable de détermination de l'enchaînement carboné d'un alcaloïde, c'est-à-dire de son squelette moléculaire, souvent même avec sa configuration spatiale. Le spectre de masse est fondé sur l'ionisation d'une molécule dans le vide par divers agents (bombardement d'électrons ou d'ions, champ électrique). Si... -
ANALYSE ET SYNTHÈSE, chimie
- Écrit par Pierre LASZLO
- 1 526 mots
- 1 média
Ces deux notions, en principe complémentaires et réciproques, ne le sont pas en fait. Certes, les deux tendances à l'analyse et à la synthèse s'opposent, la première visant à couper les entités chimiques en petits morceaux et la seconde se donnant pour objectif la reconstruction des ensembles mis à...
- Afficher les 19 références
Voir aussi
- SPECTROCHIMIQUE ANALYSE
- FOCALISATION, physique
- QUISTOR (quadripole ion storage device)
- IONS
- CHAMP ÉLECTRIQUE
- CHAMP MAGNÉTIQUE
- ACCÉLÉRATEURS CIRCULAIRES
- SCHOTTKY BRUIT DE ou BRUIT DE GRENAILLE
- ISOTOPES
- CYCLOTRON
- IONISATION
- POUVOIR DE RÉSOLUTION
- NOYAU ATOMIQUE
- DÉTECTEURS DE PARTICULES
- MESURE INSTRUMENTS DE
- QUADRIPÔLES, électricité
- TRAJECTOIRE
- DÉCHARGE ÉLECTRIQUE
- SCIENCES HISTOIRE DES, XXe XXIe s.
- PLASMAS
- TEMPS DE VOL MÉTHODE DU
- ABONDANCE ISOTOPIQUE
- MASSE ATOMIQUE
- SÉPARATION, chimie
- FOURIER TRANSFORMATION DE
- BOMBARDEMENT ÉLECTRONIQUE
- MASSE MOLÉCULAIRE
- ANALYSEUR, chimie analytique
- OMÉGATRON
- IONS SOURCES D'
- BOMBARDEMENT IONIQUE
- RÉSONANCE CYCLOTRON
- FRÉQUENCE CYCLOTRON
- DYNODE
- PENNING PIÈGE DE
- SURFACES ANALYSE DES
- ÉNERGIE CINÉTIQUE
- RADIOFRÉQUENCE
- PIÈGE À IONS
- ISOCHRONISME, physique
- POTENTIEL D'IONISATION