SPECTROMÉTRIE DE MASSE
Éléments constitutifs
L'unité de masse du système international (S.I.) est le kilogramme (kg). À l'échelle microscopique, d'autres unités sont plus pratiques. En physique nucléaire et en chimie, la masse s'exprime souvent par le nombre de masse A, qui par définition est un nombre entier. Pour un atome, il est égal à la somme du numéro atomique Z (nombre de protons) et du nombre de neutrons N du noyau : A = Z + N.
On se sert également en physique nucléaire de l'unité de masse atomique, l'uma, qui vaut 1/12 de la masse de l'atome de carbone12C : 1 uma = 1,660 540 2 × 10—27 kg.
En chimie, cette unité porte le nom de dalton.
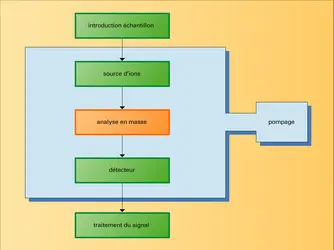
Bien que l'élément caractéristique d'un spectromètre de masse soit son système analyseur, le principe des éléments constitutifs est présenté en allant de l'introduction de l'échantillon jusqu'à la détection des ions séparés en masse.
Les systèmes d'introduction
Puisque l'analyse en masse est fondée sur les trajectoires des ions accélérés, il est important que celles-ci ne soient pas perturbées par les collisions des ions avec les molécules du gaz résiduel, d'où la nécessité de placer l'appareillage dans un vide dont la pression résiduelle soit comprise entre 10—4 et 10—7 Pa. L'échantillon à analyser, suivant son état physique : solide, liquide ou gaz, est introduit dans l'enceinte à vide au moyen d'un dispositif spécifique. Les solides sont introduits dans la source d'ions au moyen d'une canne qui franchit un sas étanche. Les liquides sont généralement vaporisés avant d'être introduits sous forme gazeuse. Les gaz sont d'abord transférés dans un réservoir vide d'air, ils pénètrent dans la source au moyen d'une microfuite réglable.
Les sources d'ions
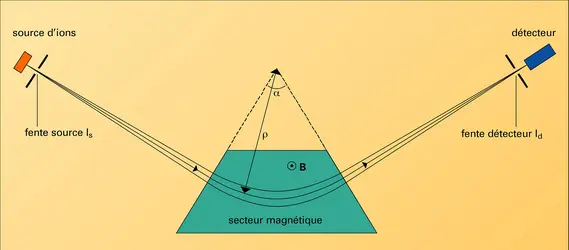
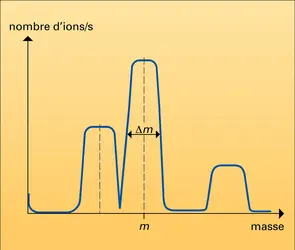
La source d'ions produit, à partir de l'échantillon, des ions qui correspondent à ses différents atomes ou groupe d'atomes constitutifs. Suivant les méthodes mises en jeu, les molécules peuvent même être brisées en une grande diversité de fragments ionisés. L'étude de la structure des molécules organiques et biologiques nécessite de disposer de sources d'ions de différents types, qui fragmentent plus ou moins les molécules. La production exclusive d'ions monochargés est préférable car la présence d'ions multichargés complique l'identification des pics dans le spectre de masse. Une source d'ions peut être caractérisée par son rendement d'ionisation, son éventuelle sélectivité chimique, sa faculté de ne pas briser les grosses molécules (ionisation douce) ou encore d'être le siège de réactions ions-molécules. Une fois formés, les ions sont extraits de la zone d'ionisation et accélérés par des champs électriques à l'aide d'une optique de focalisation. Celle-ci, constituée de plaques portées à des potentiels réglables, guide les ions vers la fente-source.
Impact électronique
Cette source, fréquemment appelée source à gaz, est la plus répandue malgré son rendement limité. Les molécules de l'échantillon gazeux sont frappées par un faisceau d'électrons de 70 eV d'énergie cinétique, énergie à laquelle l'ionisation est la plus efficace pour les molécules organiques. Il se forme alors des ions positifs : A + e— → A+ + 2e—.
La probabilité des collisions est augmentée en spiralant la trajectoire des électrons à l'aide d'un champ magnétique coaxial. Le nombre d'ions formés est proportionnel à la pression de l'échantillon et au courant électronique : c'est une méthode quantitative. Si l'échantillon n'est pas gazeux, il peut être désorbé ou vaporisé à partir d'un filament chauffé ou d'un four. La variété des ions formés dépend de l'énergie cinétique des électrons, propriété utile pour l'étude des structures moléculaires.[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Michel de SAINT SIMON : directeur de recherche au C.N.R.S., centre de spectrométrie nucléaire et de spectrométrie de masse (Institut national de physique nucléaire et de physique des particules)
Classification
Médias
Autres références
-
ÂGE DE LA TERRE
- Écrit par Pascal RICHET
- 5 143 mots
- 5 médias
...instrumentaux furent cependant nécessaires. Il était en effet impossible de mesurer précisément des abondances isotopiques par des analyses chimiques. Ce fut le spectromètre de masse qui permit de le faire en séparant les isotopes comme un prisme décompose la lumière. Descendant des tubes cathodiques... -
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES et Rémi JULLIEN
- 1 616 mots
- 7 médias
...gazeux (ou accélérés, s'ils sont chargés) et dirigés vers une enceinte où on les étudie « en vol ». Parmi les nombreuses méthodes physiques utilisées, la spectrométrie de masse est la plus importante. Elle permet en effet de classer les agrégats selon le nombre N d'atomes ou de molécules qu'ils contiennent.... -
ALCALOÏDES
- Écrit par Jacques E. POISSON
- 5 686 mots
- 5 médias
...irremplaçable de détermination de l'enchaînement carboné d'un alcaloïde, c'est-à-dire de son squelette moléculaire, souvent même avec sa configuration spatiale. Le spectre de masse est fondé sur l'ionisation d'une molécule dans le vide par divers agents (bombardement d'électrons ou d'ions, champ électrique). Si... -
ANALYSE ET SYNTHÈSE, chimie
- Écrit par Pierre LASZLO
- 1 526 mots
- 1 média
Ces deux notions, en principe complémentaires et réciproques, ne le sont pas en fait. Certes, les deux tendances à l'analyse et à la synthèse s'opposent, la première visant à couper les entités chimiques en petits morceaux et la seconde se donnant pour objectif la reconstruction des ensembles mis à...
- Afficher les 19 références