STÉRÉOCHIMIE Stéréochimie et liaison chimique
Article modifié le
Bien qu'usuellement développée à partir de résultats expérimentaux, la stéréochimie entre dans le cadre général de la théorie de la liaison chimique et, de ce fait, peut recevoir un support théorique.
Une remarque préliminaire est cependant nécessaire. La géométrie d'une molécule est essentiellement conditionnée par son énergie. Or, celle-ci est attribuée à l'édifice dans son ensemble, si bien que les règles de base de la stéréochimie, qui sont pour la plupart fondées sur les interactions entre les diverses parties, plus ou moins étendues, de la molécule, ne pourront trouver une justification théorique que dans la mesure où il sera possible de découper la molécule en fragments tels que l'énergie totale apparaisse, en première approximation, comme la somme des énergies de ces fragments, quitte à corriger cette énergie par des termes dits d'interaction. La stéréochimie est par là même étroitement liée à la description qu'on envisagera pour la molécule.
Localisation des paires d'électrons
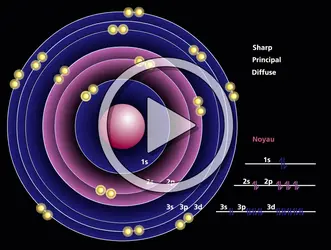
Pour étudier la localisation des paires d'électrons dans les molécules, on se placera dans le cadre de la méthode des orbitales moléculaires. Dans cette dernière, les électrons sont associés par paires, de spins antiparallèles, sur des niveaux moléculaires décrits par des fonctions d'onde, appelées orbitales moléculaires. Pour ces fonctions, on utilise des combinaisons linéaires orthonormées de fonctions susceptibles de décrire les électrons dans les atomes isolés. Les coefficients de ces fonctions sont déterminés de façon que l'énergie totale du système soit minimale. La densité électronique qui correspond à chaque paire d'électrons est répandue sur toute la molécule.
En principe, toute base de fonctions atomiques convient pour construire les orbitales moléculaires. Mais, comme une base complète est infinie et que dans la pratique on ne peut introduire qu'un nombre restreint de fonctions, le problème de la dimension de la base se pose d'une façon aiguë. Il est cependant évident que, pour obtenir une précision donnée sur l'énergie, le nombre de fonctions atomiques à introduire dépendra fortement du type de fonctions utilisées. Plus celles-ci se rapprocheront de la solution exacte, moins grand sera le nombre de fonctions à introduire. Or, le champ de force auquel est soumis un électron dans une molécule au voisinage de chaque noyau est très voisin de celui auquel il serait soumis si cet atome était isolé. Autour de chaque noyau, les fonctions moléculaires s'identifient pratiquement aux fonctions atomiques exactes, et l'on aura intérêt à choisir pour base de développement les fonctions ou orbitales atomiques relatives aux atomes isolés.
D'autre part, le calcul montre que, dans la plupart des cas, seules les orbitales atomiques utilisées par les électrons dans l'état fondamental des atomes isolés, ou celles d'énergies très voisines, entrent dans l'expression des orbitales moléculaires avec un poids notable, si bien que l'on peut obtenir une description très convenable des molécules en se contentant de cette base tronquée, dite minimale. Par exemple, pour l'atome de carbone, on introduira seulement les orbitales 1s, 2s, et 2p.
Une fois la base de développement choisie, la minimisation de l'énergie fournit un jeu d'orbitales moléculaires ϕ orthonormées qui n'est pas unique. En effet, toute combinaison linéaire orthonormée ϕ′ de ces fonctions convient, si toutes les orbitales moléculaires initiales ϕ correspondent à des niveaux doublement occupés, ce qui est en général le cas. En effet, l'énergie et la densité électronique totales ne sont alors pas modifiées, bien que les densités électroniques relatives aux paires d'électrons prises individuellement le soient.
Profitant de cette indétermination[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André JULG : professeur émérite à l'université de Provence
Classification
Média
Autres références
-
AMPÈRE ANDRÉ-MARIE (1775-1836)
- Écrit par Louis POUDENSAN
- 1 788 mots
- 1 média
...s'arrête pas à l'énoncé de cette loi ; il cherche à en déduire la forme et l'arrangement des atomes pour prévoir leurs combinaisons, leurs substitutions. Il conçoit ce que l'on appelle aujourd'hui la stéréochimie qui, à son époque, ne fut considérée que comme « une fantaisie révolutionnaire ». -
BARTON DEREK HAROLD RICHARD (1918-1998)
- Écrit par Georges BRAM
- 485 mots
- 1 média
Chimiste britannique né à Gravesend (Kent). Derek Harold Richard Barton obtient son doctorat en 1942 à l'Imperial College de l'université de Londres, où il travaille deux ans dans un laboratoire dépendant des autorités militaires. Après un an passé dans l'industrie chimique, il retourne à l'Imperial...
-
CHIMIE THÉORIQUE
- Écrit par Lionel SALEM et François VOLATRON
- 4 290 mots
- 10 médias
...cas présent, de la symétrie spatiale des orbitales moléculaires. Woodward et Hoffmann ont considéré la réaction de fermeture de cycle de la molécule de butadiène. Ils ont fait remarquer que, pour une molécule portant des substituants différents X et Y aux deux bouts, deux produits distincts peuvent être... -
CHIRALITÉ, chimie
- Écrit par Pierre LASZLO
- 1 348 mots
Un objet est chiral s'il n'est pas superposable à son image dans un miroir, ou image spéculaire. Nos mains appartiennent à cette classe des objets chiraux, d'où leur nom, dérivé du grec kheir, « main ». Nos mains, gauche et droite, sont l'image spéculaire l'une de l'autre. De la...
- Afficher les 23 références
Voir aussi