STÉRÉOCHIMIE Stéréochimie inorganique
Article modifié le
Isomérie
On appelle isomères les molécules ou les ions qui ont la même formule brute mais des arrangements différents de leurs atomes. Cette définition restreinte peut être élargie. C'est ainsi qu'en chimie minérale, on désigne par isomérie électronique une isomérie qui ne concerne pas l'arrangement des atomes, mais une répartition différente des électrons dans les orbitales. Il est bien entendu que les composés ont toujours la même composition chimique.
Si une même substance peut exister sous plusieurs formes cristallines, ce ne sont pas toujours des isomères. L'exemple le plus simple est celui du soufre qui cristallise dans le système monoclinique ou dans le système orthorhombique suivant les conditions opératoires. Les cristaux contiennent dans les deux cas des cycles de surface non plane avec huit atomes de soufre.
Isomérie géométrique
Deux isomères géométriques se distinguent par une répartition différente des atomes dans l'espace autour de l'élément central. Si les coordinats sont proches, on dira qu'ils sont en position cis ; s'ils sont opposés, ils sont en position trans. Cette isomérie n'a jamais été rencontrée avec le tétraèdre pour des raisons géométriques, mais elle existe avec de nombreuses coordinences. Nous l'examinerons dans le cas du plan et de l'octaèdre.
Cas du plan
Les composés plans se rencontrent principalement avec la configuration électronique d8. Les exemples les plus couramment rencontrés le sont effectivement avec le nickel (II), le platine (II), le palladium (II), le rhodium (I), l'iridium (I), l'or (III). Parmi ceux-ci, c'est le platine (II) qui a été le plus étudié. Pour un composé plan Mabcd, où les lettres a, b, c, d représentent des coordinats, il y a trois sortes d'isomères géométriques.
Pour un composé plan Ma2b2, on a deux isomères cis et trans.
On peut prévoir la synthèse de ces deux isomères en considérant ce qu'on appelle l'effet trans. Si l'on part de l'ion PtCl42-, par réaction avec NH3 on obtient une première substitution sur l'un quelconque des quatre sommets avec formation de l'ion (PtCl3NH3)-.
Puis l'effet trans du ligand Cl- étant plus important que celui du ligand NH3, la deuxième substitution se fera en position trans par rapport au ligand Cl- ; on a la réaction.
Si l'on part de l'ion [Pt(NH3)4]2+, on obtient dans une première substitution l'ion PtCl(NH3)3+. La deuxième substitution se fera en trans par rapport au ligand Cl- (réaction).
Les ligands peuvent être classés en tenant compte de l'effet trans :
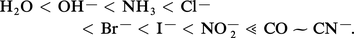
Cet effet est le plus important avec le coordinat CN-.
Cas de l'octaèdre
Dans le cas de l'octaèdre les isomères géométriques connus sont très nombreux. Ils présentent des colorations différentes avec les ions des éléments de transition. Citons l'exemple du cation de cobalt (III) [CoCl2(NH3)4]+, devenu classique depuis Werner (réaction).
En tenant compte du théorème de Polya (cf. J. Sala-Pala et J.-É. Guerchais, 1969), on calcule le nombre d'isomères géométriques et de paires d' énantiomères. Pour un octaèdre, on obtient le tableau.
Remarquons que, si deux isomères géométriques sont théoriquement prévus pour une formule Ma2b4, il y a des cas où seule l'une des formes est observée comme (OsO2X4)2- (forme trans) et (MoO2X4)2- (forme cis). Avec X, coordinat monodenté négatif, les formes préférentielles s'expliquent par le recouvrement des orbitales d du molybdène et de l'osmium avec les orbitales pπ de l'oxygène. La formation de liaison à caractère π fait que les liaisons avec l'oxygène sont fortes et courtes. On constate que l'ordre de la liaison y est plus important en comparant les relations entre les distances de l'ion métallique à l'oxygène, les constantes de forces et l'ordre des liaisons.[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques-Émile GUERCHAIS : professeur à l'université de Bretagne-Occidentale, Brest, responsable du laboratoire de chimie inorganique moléculaire de l'université de Bretagne-Occidentale
Classification
Médias
Autres références
-
AMPÈRE ANDRÉ-MARIE (1775-1836)
- Écrit par Louis POUDENSAN
- 1 788 mots
- 1 média
...s'arrête pas à l'énoncé de cette loi ; il cherche à en déduire la forme et l'arrangement des atomes pour prévoir leurs combinaisons, leurs substitutions. Il conçoit ce que l'on appelle aujourd'hui la stéréochimie qui, à son époque, ne fut considérée que comme « une fantaisie révolutionnaire ». -
BARTON DEREK HAROLD RICHARD (1918-1998)
- Écrit par Georges BRAM
- 485 mots
- 1 média
Chimiste britannique né à Gravesend (Kent). Derek Harold Richard Barton obtient son doctorat en 1942 à l'Imperial College de l'université de Londres, où il travaille deux ans dans un laboratoire dépendant des autorités militaires. Après un an passé dans l'industrie chimique, il retourne à l'Imperial...
-
CHIMIE THÉORIQUE
- Écrit par Lionel SALEM et François VOLATRON
- 4 290 mots
- 10 médias
...cas présent, de la symétrie spatiale des orbitales moléculaires. Woodward et Hoffmann ont considéré la réaction de fermeture de cycle de la molécule de butadiène. Ils ont fait remarquer que, pour une molécule portant des substituants différents X et Y aux deux bouts, deux produits distincts peuvent être... -
CHIRALITÉ, chimie
- Écrit par Pierre LASZLO
- 1 348 mots
Un objet est chiral s'il n'est pas superposable à son image dans un miroir, ou image spéculaire. Nos mains appartiennent à cette classe des objets chiraux, d'où leur nom, dérivé du grec kheir, « main ». Nos mains, gauche et droite, sont l'image spéculaire l'une de l'autre. De la...
- Afficher les 23 références
Voir aussi
- POLYMÉRISATION
- CIS CONFIGURATION
- TRANS CONFIGURATION
- IONS
- COORDINENCE ou NOMBRE DE COORDINATION
- MINÉRALE CHIMIE
- LIGAND ou COORDINAT, chimie
- HYDRATATION
- CHÉLATES
- POUVOIR ROTATOIRE
- TÉTRAÈDRE, stéréochimie
- ACTIVITÉ OPTIQUE
- OCTAÈDRE, stéréochimie
- CONFIGURATION ÉLECTRONIQUE
- DIASTÉRÉO-ISOMÉRIE
- ÉNANTIOMÈRES ou INVERSES OPTIQUES ou ANTIPODES OPTIQUES
- IONIQUE LIAISON
- CHAMP DE COORDINATS THÉORIE DU
- PEARSON RALPH GOTTFRIED (1919- )
- COORDINATION COMPOSÉS DE











