STÉRÉOCHIMIE Stéréochimie organique
Article modifié le
Stéréochimie dynamique
Empêchement stérique
Les atomes sont impénétrables ; chacun d'eux est entouré d'une région, dite sphère de Van der Waals, qui en interdit l'accès. Pour cette raison, on ne peut concevoir aucune structure, ni aucune conformation dans laquelle divers atomes sont trop proches les uns des autres ; une première manifestation de cette interférence est l'explication de l'atropo-isomérie, et la prédominance de la position équatoriale des substituants volumineux. De même, l'accès à des molécules très encombrées (carbone uni à quatre substituants très ramifiés) est en général très difficile, parfois impossible.
D'autre part, les substituants d'un carbone et les proches ramifications de ses voisins immédiats forment écran vis-à-vis des agents nucléophiles qui doivent attaquer ce carbone (processus SN2) ; c'est ainsi que les carbones primaires sont les plus accessibles, et qu'un halogénure tel que [(CH3)3C]3CBr ne peut subir aucune substitution de processus SN2. On a donné à cet effet d'écran le nom d'empêchement stérique. La libre rotation atténue parfois l'empêchement stérique, car la gêne stérique peut disparaître chez certaines conformations ; c'est pourquoi le phénomène est beaucoup plus net dans le cas de molécules rigides ; l'empêchement stérique des radicaux R1 et R2 ralentit ou entrave de nombreuses réactions des composés (50). Mais l'effet stérique n'est pas toujours une diminution de la réactivité : dans le bromure [(CH3)3C]3CBr, les trois radicaux tertiobutyle interfèrent et s'écartent ; on dit qu'il existe une compression stérique ; celle-ci diminue lors d'un départ éventuel de l'ion Br- qui libère le carbocation [(CH3)3C]3C+ dans lequel C+ et les trois carbones qui lui sont directement reliés sont coplanaires. En conséquence, ce carbocation se forme très facilement et les réactions dites SN1, dans lesquelles ce carbocation intervient, deviennent d'une étonnante facilité : on a donné à ce phénomène le nom d'accélération stérique.
Enfin, l'empêchement stérique peut avoir d'autres conséquences ; des radicaux encombrants entravent la coplanéité de deux noyaux benzéniques directement reliés ; il s'ensuit une diminution de la conjugaison qui peut influer dans un sens ou dans l'autre sur la réactivité de la molécule : alors que le butadiène n'a qu'une désaturation moyenne, un dérivé substitué par des radicaux R très encombrants (R)2C=C(R)−C(R)=CR2 se comporte parfois comme le biradical :
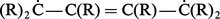
Fermeture des chaînes
Le passage d'un composé acyclique à un composé cyclique dépend de deux facteurs : la probabilité de position favorable, qui décroît lorsque le nombre n d'atomes du cycle escompté augmente, et la tension qui diminue lorsque ce nombre croît de 2 à 5, pour devenir nulle ensuite. De l'antagonisme de ces facteurs découle une grande irrégularité dans les « facilités de cyclisation ». Laissant de côté le cycle à deux atomes (double liaison) qui est un peu particulier, on peut dire que la facilité de fermeture (nombre de réactions cyclisantes connues), en fonction de n, se classe dans l'ordre décroissant suivant : 5, 6, 7, 3, n > 7 et 4. Pendant très longtemps, on n'avait connu qu'une réaction de cyclisation quadrangulaire ; cet ordre est sujet à modifications du fait de la découverte de nouvelles réactions.
Inversion de Walden
Soit (51) la projection conventionnelle d'un composé actif (d). Lorsqu'on effectue sur lui une réaction réelle remplaçant, dans la formule plane, T par T′, quelle sera la projection conventionnelle de T′, (52) ou (53) ? L'expérience montre qu'on ne peut rien conclure[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri B. KAGAN : professeur de chimie à l'université de Paris-Sud, membre de l'Académie des sciences
- Charles PRÉVOST : professeur à la faculté des sciences de Paris, à l'École centrale des arts et manufactures de Paris et à l'École normale supérieure de Fontenay-aux-Roses
Classification
Médias
Autres références
-
AMPÈRE ANDRÉ-MARIE (1775-1836)
- Écrit par Louis POUDENSAN
- 1 788 mots
- 1 média
...s'arrête pas à l'énoncé de cette loi ; il cherche à en déduire la forme et l'arrangement des atomes pour prévoir leurs combinaisons, leurs substitutions. Il conçoit ce que l'on appelle aujourd'hui la stéréochimie qui, à son époque, ne fut considérée que comme « une fantaisie révolutionnaire ». -
BARTON DEREK HAROLD RICHARD (1918-1998)
- Écrit par Georges BRAM
- 485 mots
- 1 média
Chimiste britannique né à Gravesend (Kent). Derek Harold Richard Barton obtient son doctorat en 1942 à l'Imperial College de l'université de Londres, où il travaille deux ans dans un laboratoire dépendant des autorités militaires. Après un an passé dans l'industrie chimique, il retourne à l'Imperial...
-
CHIMIE THÉORIQUE
- Écrit par Lionel SALEM et François VOLATRON
- 4 290 mots
- 10 médias
...cas présent, de la symétrie spatiale des orbitales moléculaires. Woodward et Hoffmann ont considéré la réaction de fermeture de cycle de la molécule de butadiène. Ils ont fait remarquer que, pour une molécule portant des substituants différents X et Y aux deux bouts, deux produits distincts peuvent être... -
CHIRALITÉ, chimie
- Écrit par Pierre LASZLO
- 1 348 mots
Un objet est chiral s'il n'est pas superposable à son image dans un miroir, ou image spéculaire. Nos mains appartiennent à cette classe des objets chiraux, d'où leur nom, dérivé du grec kheir, « main ». Nos mains, gauche et droite, sont l'image spéculaire l'une de l'autre. De la...
- Afficher les 23 références
Voir aussi
- CIS CONFIGURATION
- TRANS CONFIGURATION
- ENZYMES
- RÉACTIONNELS MÉCANISMES
- SUBSTITUANT, chimie
- CYCLIQUES COMPOSÉS
- PHOSPHINE (phosphure d'hydrogène)
- HYBRIDATION DES ORBITALES
- LIBRE ROTATION, chimie
- NEWMAN PROJECTION DE
- CONFIGURATION MOLÉCULAIRE
- HYDROGÉNATION
- CLATHRATES
- DOUBLE LIAISON ou LIAISON ÉTHYLÉNIQUE
- CHAISE CONFORMATION
- BATEAU CONFORMATION
- ÉQUATORIALE LIAISON
- AXIALE LIAISON
- ÉCLIPSÉE CONFORMATION
- ADDITION, chimie
- CYCLISATION
- SÉPARATION, chimie
- DEXTROGYRE CORPS
- POUVOIR ROTATOIRE
- WALDEN INVERSION DE
- LÉVOGYRE CORPS
- CRISTALLISATION
- RACÉMIQUE
- HÉTÉROATOME
- FORMULE DÉVELOPPÉE PLANE
- TÉTRAÈDRE, stéréochimie
- THRÉO ISOMÈRE
- SPIRANNE
- RÉTENTION DE STRUCTURE, chimie
- CARBONE ASYMÉTRIQUE
- ÉRYTHRO ISOMÈRE
- STÉRIQUE EFFET ou EMPÊCHEMENT
- ATROPO-ISOMÉRIE
- MÉSO ISOMÈRE
- DIASTÉRÉO-ISOMÉRIE
- ÉPIMÉRISATION
- CATALYSE ASYMÉTRIQUE
- FORMULE SPATIALE, chimie
- NOMENCLATURE, chimie
- STÉRÉO-ISOMÉRIE
- ÉNANTIOMÈRES ou INVERSES OPTIQUES ou ANTIPODES OPTIQUES
- PROCHIRALITÉ
- STABILITÉ, chimie
- MOLÉCULES BIOLOGIQUES, structure et fonction
- MACROMOLÉCULES BIOLOGIQUES
- RACÉMISATION
- CRISTALLISATION FRACTIONNÉE
- RÉCEPTEUR, biochimie
- AUTOCATALYSE







