STÉRÉOCHIMIE Stéréochimie organique
Chiralité et synthèse asymétrique
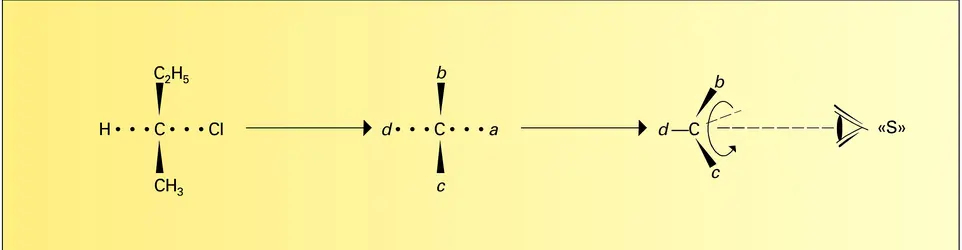
Durant les dix dernières années, de grands progrès ont été accomplis dans les méthodes d'études des structures chirales. Celles-ci sont importantes car elles interviennent dans beaucoup de processus biologiques. La majorité des molécules d'intérêt biologique sont chirales (polypeptides, enzymes, stéroïdes, prostaglandines, etc.). Les plus simples d'entre elles peuvent être obtenues par synthèse totale, mais seul l'énantiomère ayant la configuration absolue désirée (cf. supra, figure) doit être sélectivement préparé.
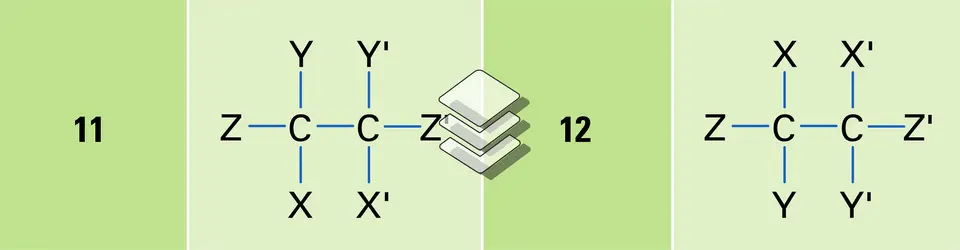
Le terme chiralité est dérivé du nom grec kheir (χέιρ, main) et caractérise deux objets qui, comme une main droite et une main gauche, sont différents tout en paraissant similaires. La distinction ne réside pas dans des dimensions ou des formes respectives. Une main gauche et une main droite ne peuvent être amenées en superposition, elles se déduisent l'une de l'autre par une symétrie par rapport à un plan. Presque tous les constituants chimiques des systèmes vivants sont chiraux : polypeptides, protéines, glucides, acides nucléiques ; la chiralité est une des caractéristiques des organismes vivants. C'est, toutefois, à une date relativement récente (1950-1960) que ce terme utilisé par le physicien lord Kelvin au début du siècle a été introduit en chimie par Cahn, Ingold, Prelog, Mislow. Il devenait, en effet, indispensable de disposer d'un mot caractérisant des espèces moléculaires les plus variées qui peuvent exister sous forme de deux stéréo-isomères, image l'un de l'autre par rapport à un plan miroir. Le mot chiralité ne fait pas appel à des considérations de symétrie, il s'applique à tout composé pouvant avoir une image non superposable, appelé composé antipode ou énantiomère. Par exemple, l'acide lactique (formule 63) est dépourvu d'éléments de symétrie (c'est un composé asymétrique), le trans-diméthyl-1,2cyclopropane (formule 64) comporte un axe de symétrie d'ordre 2 (C2), le perhydrotriphénylène (formules 65 et 66) comporte un axe de symétrie d'ordre 3 (C3) et trois axes de symétrie d'ordre 2, perpendiculaires au premier. Ces composés (formules 63, 64, 65) ne sont pas superposables à leurs images par rapport à un plan ; ils sont donc doués de chiralité. Pour reconnaître si une molécule est chirale, il suffit de vérifier l'absence des éléments de symétrie suivants : plan de symétrie, centre de symétrie et axe impropre de symétrie Sn (combinaison d'une rotation de 2 π/n et d'une symétrie par rapport à un plan perpendiculaire à l'axe de rotation). Ainsi, le spiranne (formule 67), dépourvu de plan et de centre de symétrie, n'est pas chiral à cause de la présence d'un axe de symétrie S4.
Divers aspects de la chiralité
Structures chirales
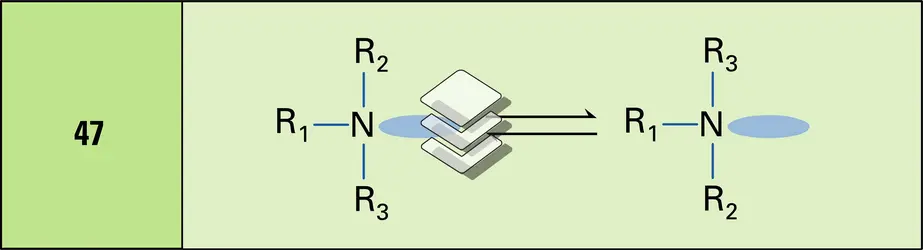
Certains composés chiraux ont un carbone ou un soufre asymétrique et sont donc caractérisés par un pouvoir rotatoire (cf. supra, Carbone asymétrique). On connaît maintenant de nombreux autres atomes asymétriques. Par exemple des phosphines (formule 68) ont été dédoublées. Du fait que l'azote incorporé dans des petits cycles ne s'inverse pas, l'aziridine (formule 69) optiquement active a été isolée. Un métal de transition tel que le manganèse (Mn), le fer (Fe) ou le chrome (Cr) peut jouer le rôle d'un centre asymétrique. C'est ainsi que le complexe métallique obtenu avec le fer (formule 70) a été dédoublé. Les cas d' atropo-isomérie (cf. supra, Atropo-isomérie) se rencontrent de plus en plus fréquemment, donnant naissance à des énantiomères stables du fait d'empêchement de la rotation autour de liaisons C−C, comme pour certaines benzophénones (formule 71) ou l'hexahélicène (formule 72). Cette dernière molécule ne peut exister sous la conformation plane habituelle[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri B. KAGAN : professeur de chimie à l'université de Paris-Sud, membre de l'Académie des sciences
- Charles PRÉVOST : professeur à la faculté des sciences de Paris, à l'École centrale des arts et manufactures de Paris et à l'École normale supérieure de Fontenay-aux-Roses
Classification
Médias
Autres références
-
AMPÈRE ANDRÉ-MARIE (1775-1836)
- Écrit par Louis POUDENSAN
- 1 788 mots
- 1 média
...s'arrête pas à l'énoncé de cette loi ; il cherche à en déduire la forme et l'arrangement des atomes pour prévoir leurs combinaisons, leurs substitutions. Il conçoit ce que l'on appelle aujourd'hui la stéréochimie qui, à son époque, ne fut considérée que comme « une fantaisie révolutionnaire ». -
BARTON DEREK HAROLD RICHARD (1918-1998)
- Écrit par Georges BRAM
- 485 mots
- 1 média
Chimiste britannique né à Gravesend (Kent). Derek Harold Richard Barton obtient son doctorat en 1942 à l'Imperial College de l'université de Londres, où il travaille deux ans dans un laboratoire dépendant des autorités militaires. Après un an passé dans l'industrie chimique, il retourne à l'Imperial...
-
CHIMIE THÉORIQUE
- Écrit par Lionel SALEM et François VOLATRON
- 4 290 mots
- 10 médias
...cas présent, de la symétrie spatiale des orbitales moléculaires. Woodward et Hoffmann ont considéré la réaction de fermeture de cycle de la molécule de butadiène. Ils ont fait remarquer que, pour une molécule portant des substituants différents X et Y aux deux bouts, deux produits distincts peuvent être... -
CHIRALITÉ, chimie
- Écrit par Pierre LASZLO
- 1 348 mots
Un objet est chiral s'il n'est pas superposable à son image dans un miroir, ou image spéculaire. Nos mains appartiennent à cette classe des objets chiraux, d'où leur nom, dérivé du grec kheir, « main ». Nos mains, gauche et droite, sont l'image spéculaire l'une de l'autre. De la...
- Afficher les 23 références