STÉROÏDES
Les stéroïdes non hormonaux
Dans ce vaste ensemble se côtoient des substances de structures assez différentes, d'activité et d'importance biologiques très variables : il s'agit des stérols, des acides, sels et alcools biliaires, des stéroïdes alcaloïdiques, des stéroïdes des venins, des hétérosides cardiotoniques, des sapogénines, des stéroïdes fossiles et des hopanoïdes (molécules apparentées aux stéroïdes). Certains de ces produits non hormonaux ont un intérêt biologique (cf. alcaloïdes, polyhol- osides et hétérosides et venins).
Les stérols
Les stérols, très largement répandus dans le monde vivant, se rencontrent aussi bien chez les bactéries, les champignons, les plantes supérieures, les protozoaires que chez les métazoaires (spongiaires, madrépores, vers, mollusques, insectes, poissons, reptiles, mammifères).
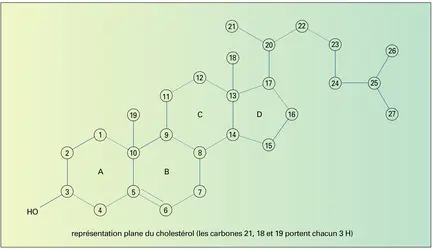
Du point de vue structural (pour la numérotation, voir ), ils se caractérisent par la présence en position 3, en général β du noyau cyclopenténophénanthrénique, d'un hydroxyle libre, éthérifié (glycosides) ou estérifié (stérides : sans intérêt pharmacologique connu), de deux méthyles en position 10β, 13β et d'une chaîne carbonée en 17β. De nombreux stérols sont insaturés : en C-5 (souvent), simultanément en C-7 et C-22 (assez souvent) et en C-7 (parfois). Ils sont alors appelés sténols par opposition à leurs homologues saturés, les stanols. Les stérols ont la faculté de former, entre eux ou avec des saponiens, des combinaisons non covalentes. Cette propriété, découverte par A. Windaus, explique l'action détoxifiante du cholestérol à l'égard de poisons renfermant des saponiens (exemple : venin d'abeille dont les saponines sont des dérivés de stérols végétaux recueillis au cours du butinage). Sous l'effet des acides forts, la fonction hydroxyle des stérols conduit à des réactions colorées permettant de les doser.
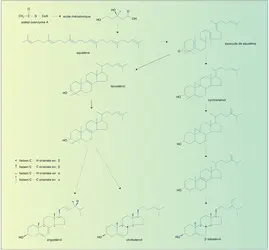
Quant à leur biosynthèse, les travaux de Cornforth ont montré que les stérols dérivent tous d'une molécule relativement simple, l' acide mévalonique, bioprécurseur d'un intermédiaire clef, le squalène. Des réactions enzymatiques interviennent ensuite, différentes d'un règne à l'autre, avec des variantes suivant les espèces. Dans le monde végétal, elles conduisent aux phytostérols, comme le β-sitostérol et le stigmastérol, et aux mycostérols, comme l' ergostérol. Dans le règne animal, elles permettent l'élaboration des zoostérols dont le plus important est le cholestérol.
En effet, le β-sitostérol et son analogue insaturé 21-24, le stigmastérol, représentent plus de 80 p. 100 des phytostérols, tandis que le cholestérol, présent chez les mammifères en tant que constituant des membranes cellulaires, est une véritable plaque tournante, précurseur des hormones stéroïdes et des acides biliaires. Ces stérols, animaux et végétaux, sont en outre des matières premières pour l'hémisynthèse industrielle des stéroïdes hormonaux.
On sait, depuis les travaux de P. Benveniste, que les eucaryotes chlorophylliens, c'est-à-dire les végétaux et certaines algues, transforment l'époxyde de squalène en cycloarténol. Ce stérol cyclopropanique isomère du lanostérol donne naissance, par modifications enzymatiques successives, au β-sitostérol, homologue éthylé en 24 du cholestérol. Les eucaryotes non chlorophylliens réarrangent l'époxyde de squalène en lanostérol. Celui-ci est utilisé par les levures et certains champignons pour produire de l'ergostérol alors que les animaux supérieurs le convertissent en cholestérol dont le mécanisme de biosynthèse a été établi, grâce au marquage isotopique, par les équipes de Bloch, Cornforth et Popjack.
Ces diverses transformations impliquent la perte de plusieurs atomes de carbone par déméthylations enzymatiques suivies de la[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Dominique BIDET : docteur en pharmacie, ingénieur documentaliste au service de documentation biologique et pharmaco-chimique, Centre de recherche Roussel-Uclaf
- Jean-Cyr GAIGNAULT : docteur en pharmacie à l'université de Paris, docteur ès sciences physiques, membre de l'Académie nationale de pharmacie
- Jacques PERRONNET : ingénieur E.S.P.C.I., docteur ès sciences, attaché scientifique à l'Institut scientifique Roussel
- Daniel PHILIBERT : licencié ès sciences physiques, chef du service d'endocrinologie, Roussel-Uclaf
Classification
Médias
Autres références
-
ALDOSTÉRONE
- Écrit par Pierre KAMOUN
- 1 642 mots
Dès 1934, Wintersteiner démontrait que l'animal, privé de surrénales, pouvait être maintenu en vie à l'aide d'une fraction amorphe extraite de la partie corticale de ces glandes.
En 1953, Wettstein et Reichstein ont isolé, à partir de cette fraction, une substance hormonale comportant...
-
ANABOLISANTS
- Écrit par Marie-Christine STÉRIN
- 160 mots
Non seulement les anabolisants accroissent le processus de construction des tissus vivants, ils sont aussi des substances susceptibles de modifier le métabolisme de ces derniers. Il s'agit essentiellement de dérivés des hormones mâles favorisant l'anabolisme protidique, ce qui se traduit...
-
ANDROGÈNES
- Écrit par Dominique BIDET , Jean-Cyr GAIGNAULT et Jacques PERRONNET
- 983 mots
-
ANTIHORMONES
- Écrit par Dominique BIDET , Jean-Cyr GAIGNAULT et Jacques PERRONNET
- 772 mots
La notion d'antihormone s'applique aujourd'hui aux molécules capables d'inhiber de façon compétitive la formation du complexe hormone-récepteur. Sa définition première, désignant toute substance capable de s'opposer aux effets résultant de l'action d'une hormone, a donc été...
- Afficher les 28 références