IONIQUES STRUCTURES
Article modifié le
Si la présence d' ions au sein de solutions salines ou de sels fondus semblait depuis longtemps bien établie, notamment par des études de conductivité électrique, l'extension de la notion d'ion à l'édifice cristallin reposait par contre sur un postulat dont le succès résidait essentiellement dans l'obtention par le calcul, pour les énergies réticulaires de certains types de cristaux, de valeurs très satisfaisantes. Les développements des techniques de rayons X, en offrant la possibilité de dresser pour un cristal de véritables cartes de densités électroniques, ont permis de démontrer d'une manière directe l'existence d'ions au sein de certains types de réseaux, et de valider ainsi le postulat de la liaison ionique.
Un cristal ionique est formé par un assemblage géométrique simple d'ions chargés positivement, les cations, et d'ions chargés négativement, les anions, l'énergie qui assure la cohésion du cristal, ou l'énergie réticulaire, étant d'origine essentiellement électrostatique.
Le nombre des composés à caractère ionique prédominant est très important ; cette catégorie englobe une grande partie des composés de la chimie minérale et des constituants de nombreuses variétés de roches. Cependant, les cristaux purement ioniques sont rares, ils se limitent pratiquement aux fluorures et chlorures des métaux alcalins lourds ; en effet, une évolution vers un caractère plus covalent – ou homopolaire – apparaît rapidement pour les autres composés.
Rayons ioniques
W. L. Bragg en 1920, puis V. M. Goldschmidt en 1926, étudiant de manière systématique un grand nombre de structures ioniques, montraient que les ions pouvaient être considérés comme des sphères électriquement chargées possédant des rayons bien caractéristiques et constants ; en particulier, dans la série des halogénures alcalins, les variations régulières des distances internucléaires cation-anion, obtenues avec précision à partir de leurs paramètres cristallins déterminés par diffraction X (cf. cristaux Cristallographie), étaient en bon accord avec cette hypothèse. Ces valeurs ne permettaient cependant pas à elles seules la connaissance des divers rayons ioniques ; la détermination préalable du rayon d'un ion particulier s'imposait donc.
A. Landé supposait alors que, dans la structure de l'iodure de lithium correspondant au plus petit cation Li+ et au plus gros anion I-, les sphères anioniques étaient en contact ; il en déduisait immédiatement le rayon de l'ion I-, qui, dans ce cas, conditionnait seul l'arête de la maille du cristal de LiI. Dès lors, de proche en proche, l'ensemble des rayons ioniques pouvait être déterminé.
D'autres méthodes de partage des distances internucléaires furent ensuite proposées, en particulier par Goldschmidt ; elles conduisirent à des résultats très voisins de ceux de Landé. Le tableau ci-après rassemble les valeurs des rayons de quelques ions.
L. Pauling, quelques années plus tard, proposa une méthode de calcul plus théorique fondée sur l'influence de la charge nucléaire effective Zeff sur la distribution des électrons périphériques d'un ions. D'autres physiciens ont proposé, depuis, d'autres méthodes plus élaborées de calcul direct ; les résultats ne diffèrent pas sensiblement de ceux de Goldschmidt ou de Landé.
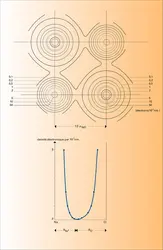
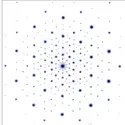
La possibilité de déterminer la densité électronique en tout point d'un cristal permet actuellement de tracer une véritable carte de cette densité électronique, comme celle qui est représentée sur la figure ; l'intégration des diverses courbes isoélectroniques permet alors de connaître le nombre total d'électrons environnant chaque noyau ; dans le cas du chlorure de sodium, pris ici comme exemple, le transfert de l'électron périphérique 3 s du sodium sur l'atome de chlore est total (Na+ : 11 − 1 = 10 électrons, Cl- : 17 + 1 = 18 électrons). Ce résultat expérimental confirme donc pleinement la théorie semi-empirique de l'édifice ionique. De plus, l'examen des densités électroniques le long d'un segment joignant les deux noyaux de sodium et de chlore permet d'observer un minimum très net correspondant à la limite entre les deux sphères anionique et cationique ; les rayons ioniques obtenus ainsi directement (RNa+ = 0,118 nm, RCl- = 0,164 nm) diffèrent cependant très notablement des valeurs précédemment admises ; ces divergences montrent bien les limites actuelles du concept de rayon ionique.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Michel POUCHARD : docteur ès sciences, professeur de chimie à l'université de Bordeaux-I, membre de l'Institut
Classification
Médias
Autres références
-
ALUNS
- Écrit par Jean PERROTEY
- 1 634 mots
-
CÉSIUM
- Écrit par Roger NASLAIN
- 1 125 mots
- 3 médias
Le césium possède les propriétés chimiques caractéristiques des éléments de la famille des alcalins. Il est extrêmement réactif, se combinant avec les éléments électronégatifs pour donner des composés typiquement ioniques, solubles dans l'eau et qui constituent des électrolytes forts. -
CRISTAUX
- Écrit par Marc AUDIER et Michel DUNEAU
- 7 292 mots
- 2 médias
L'exemple le plus courant de ces structures est le sel de cuisine, ou chlorure de sodium, de formule NaCl. Les structures ioniques sont caractérisées par la présence de deux types d'atomes, A et B, dont l'un a tendance à s'ioniser positivement, en cédant un ou plusieurs électrons (A... -
MATIÈRE (physique) - État solide
- Écrit par Daniel CALÉCKI
- 8 631 mots
- 12 médias
Le prototype descristaux ioniques est le sel gemme, NaCl, qui appartient à la famille des halogénures alcalins (NaCl, KCl, CsCl, KBr, etc.). Ces cristaux sont obligatoirement construits à partir de deux atomes différents : un atome monovalent (ne possédant qu'un électron de valence faiblement lié),... - Afficher les 8 références
Voir aussi