IONIQUES STRUCTURES
Article modifié le
Énergie de liaison dans les cristaux ioniques
Les cristaux ioniques sont généralement caractérisés par des forces de cohésion importantes ; il en résulte, pour ces composés, des températures de fusion relativement élevées. Au sein d'une même série, telle que les fluorures alcalins, elles diminuent quasi linéairement lorsque la distance internucléaire cation-anion augmente ; il en va donc de même pour l'énergie du réseau, ou énergie réticulaire.
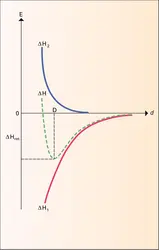
M. Born et J. R. Mayer ont montré que l'énergie d'un cristal ionique pouvait se diviser en deux termes : une énergie d'interaction coulombienne entre les divers ions porteurs de charges électriques, dont la résultante négative ΔH1, diminue lorsque l'on déplace ces ions de l'infini pour assembler le cristal ; une énergie de répulsion positive ΔH2, qui apparaît et augmente brutalement lorsque les nuages électroniques des divers ions commencent à se superposer. La résultante de ces deux termes ΔH possède un minimum correspondant à la position d'équilibre D entre cations et anions. La valeur de l'énergie réticulaire ΔH est alors donnée par l'expression :
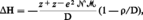
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Michel POUCHARD : docteur ès sciences, professeur de chimie à l'université de Bordeaux-I, membre de l'Institut
Classification
Médias
Autres références
-
ALUNS
- Écrit par Jean PERROTEY
- 1 634 mots
-
CÉSIUM
- Écrit par Roger NASLAIN
- 1 125 mots
- 3 médias
Le césium possède les propriétés chimiques caractéristiques des éléments de la famille des alcalins. Il est extrêmement réactif, se combinant avec les éléments électronégatifs pour donner des composés typiquement ioniques, solubles dans l'eau et qui constituent des électrolytes forts. -
CRISTAUX
- Écrit par Marc AUDIER et Michel DUNEAU
- 7 292 mots
- 2 médias
L'exemple le plus courant de ces structures est le sel de cuisine, ou chlorure de sodium, de formule NaCl. Les structures ioniques sont caractérisées par la présence de deux types d'atomes, A et B, dont l'un a tendance à s'ioniser positivement, en cédant un ou plusieurs électrons (A... -
MATIÈRE (physique) - État solide
- Écrit par Daniel CALÉCKI
- 8 631 mots
- 12 médias
Le prototype descristaux ioniques est le sel gemme, NaCl, qui appartient à la famille des halogénures alcalins (NaCl, KCl, CsCl, KBr, etc.). Ces cristaux sont obligatoirement construits à partir de deux atomes différents : un atome monovalent (ne possédant qu'un électron de valence faiblement lié),... - Afficher les 8 références
Voir aussi