IONIQUES STRUCTURES
Coordinence dans les cristaux ioniques
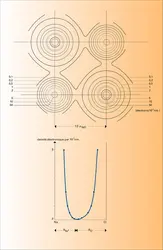
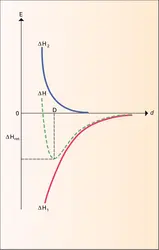
D'une manière générale et pour des structures simples, le réseau d'un composé ionique est déterminé par la coordinence des ions – c'est-à-dire par le nombre d'ions de signe opposé immédiatement à leur contact – et, plus spécialement, par la coordinence de l'ion le plus petit, le cation. L'énergie d'interaction coulombienne augmente avec la coordinence, mais celle-ci ne peut dépasser une limite imposée par les dimensions respectives de l'anion et du cation : lorsque l'on place un nombre croissant de sphères anioniques identiques autour d'un cation donné, au-delà d'un certain nombre limite, les anions ne sont plus en contact avec le cation central, trop petit, qui « flotte » littéralement dans sa cavité ; à partir de cet instant, la distance internucléaire cation-anion (D) devenant supérieure à la somme des rayons cationique et anionique, l'énergie réticulaire du réseau ainsi formé diminuerait conformément à la relation de Born et Mayer. On en déduit les valeurs limites suivantes pour le rapport x du rayon du cation au rayon de l'anion pour diverses coordinences :
– coordinence 8 cubique : x < 0,732 ;
– coordinence 6 octaédrique : x < 0,414 ;
– coordinence 4 tétraédrique : x < 0,225 ;
– coordinence 3 triangulaire : x < 0,155.
On citera pour exemple trois composés : le chlorure de césium CSCl, le chlorure de sodium NaCl et le sulfure de zinc ZnS (blende), pour lesquels le rapport x prend successivement les valeurs 0,92, 0,54 et 0,37, et dont les structures sont décrites à l'article cristaux - Cristallographie.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Michel POUCHARD : docteur ès sciences, professeur de chimie à l'université de Bordeaux-I, membre de l'Institut
Classification
Médias
Autres références
-
ALUNS
- Écrit par Jean PERROTEY
- 1 634 mots
-
CÉSIUM
- Écrit par Roger NASLAIN
- 1 125 mots
- 3 médias
Le césium possède les propriétés chimiques caractéristiques des éléments de la famille des alcalins. Il est extrêmement réactif, se combinant avec les éléments électronégatifs pour donner des composés typiquement ioniques, solubles dans l'eau et qui constituent des électrolytes forts. -
CRISTAUX
- Écrit par Marc AUDIER et Michel DUNEAU
- 7 292 mots
- 2 médias
L'exemple le plus courant de ces structures est le sel de cuisine, ou chlorure de sodium, de formule NaCl. Les structures ioniques sont caractérisées par la présence de deux types d'atomes, A et B, dont l'un a tendance à s'ioniser positivement, en cédant un ou plusieurs électrons (A... -
MATIÈRE (physique) - État solide
- Écrit par Daniel CALÉCKI
- 8 631 mots
- 12 médias
Le prototype descristaux ioniques est le sel gemme, NaCl, qui appartient à la famille des halogénures alcalins (NaCl, KCl, CsCl, KBr, etc.). Ces cristaux sont obligatoirement construits à partir de deux atomes différents : un atome monovalent (ne possédant qu'un électron de valence faiblement lié),... - Afficher les 8 références