IONIQUES STRUCTURES
Polarisation dans les cristaux ioniques
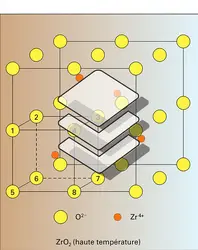
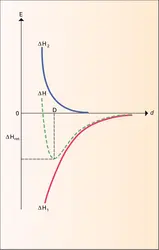
Dans les cristaux ioniques, le phénomène de polarisation correspond à une déformation du nuage électronique des ions primitivement supposés parfaitement sphériques sous l'influence du champ électrique des ions environnants. Ce phénomène, qui tend à donner à la liaison ionique un caractère directionnel, constitue un premier pas vers la liaison covalente de nature essentiellement dirigée ; cette évolution est d'autant plus marquée qu'il existe, dans le réseau, de gros anions déformables – on dit encore polarisables – et des cations très petits et fortement chargés susceptibles de produire un champ électrique intense. La diminution de la coordinence d'un cation avec sa taille s'accompagne donc d'une évolution progressive du caractère ionique au caractère covalent de la liaison. On citera comme exemple d'une telle évolu tion les trois structures des oxydes de zirconium ZrO2 (variété de haute température), de titane TiO2 (rutile) et de silicium SiO2 (cristobalite) représentées à la figure. Si l'oxyde ZrO2 peut être considéré à juste titre comme un oxyde typiquement ionique, doué même à l'état solide d'une conductivité électrique de type ionique relativement importante, la silice SiO2 correspond déjà à un oxyde assez nettement covalent, étant donné le pouvoir polarisant du silicium, porteur de quatre charges électriques formelles et caractérisé par un très faible rayon « ionique » 0,039 nm environ.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Michel POUCHARD : docteur ès sciences, professeur de chimie à l'université de Bordeaux-I, membre de l'Institut
Classification
Médias
Autres références
-
ALUNS
- Écrit par Jean PERROTEY
- 1 634 mots
-
CÉSIUM
- Écrit par Roger NASLAIN
- 1 125 mots
- 3 médias
Le césium possède les propriétés chimiques caractéristiques des éléments de la famille des alcalins. Il est extrêmement réactif, se combinant avec les éléments électronégatifs pour donner des composés typiquement ioniques, solubles dans l'eau et qui constituent des électrolytes forts. -
CRISTAUX
- Écrit par Marc AUDIER et Michel DUNEAU
- 7 292 mots
- 2 médias
L'exemple le plus courant de ces structures est le sel de cuisine, ou chlorure de sodium, de formule NaCl. Les structures ioniques sont caractérisées par la présence de deux types d'atomes, A et B, dont l'un a tendance à s'ioniser positivement, en cédant un ou plusieurs électrons (A... -
MATIÈRE (physique) - État solide
- Écrit par Daniel CALÉCKI
- 8 631 mots
- 12 médias
Le prototype descristaux ioniques est le sel gemme, NaCl, qui appartient à la famille des halogénures alcalins (NaCl, KCl, CsCl, KBr, etc.). Ces cristaux sont obligatoirement construits à partir de deux atomes différents : un atome monovalent (ne possédant qu'un électron de valence faiblement lié),... - Afficher les 8 références