IONIQUES STRUCTURES
Évolution du caractère ionique au caractère moléculaire d'un cristal
Un cristal moléculaire peut être défini comme formé par l'assemblage de molécules distinctes dont la cohésion est assurée par des forces du type Van der Waals. Celles-ci, relativement peu intenses, ne confèrent à ce type de cristaux qu'une faible stabilité ; les cristaux moléculaires ont donc des températures de fusion ou de sublimation très basses. L'apparition d'un caractère moléculaire sera décelable dans un cristal dès lors que se formeront des groupements atomiques électriquement neutres, plus ou moins volumineux, isolés les uns des autres, donc faiblement liés entre eux.
Une telle évolution se traduit, dans un premier stade, par la formation de structures à feuillets, véritables molécules géantes bidimensionnelles reliées entre elles par des forces de Van der Waals ; ces cristaux sont facilement clivables (le sulfure de molybdène MoS2 par exemple). On peut observer, dans le second stade, la formation de chaînes isolées. Le terme ultime de cette évolution correspond au groupement quasi ponctuel qu'est la molécule.
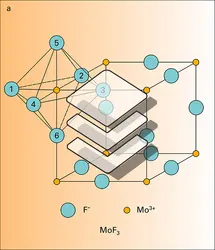
L'apparition plus ou moins marquée de ce caractère moléculaire est généralement liée à la présence dans le réseau de très gros anions fortement polarisables. Les diverses structures des halogénures MoF3, CrCl3 AlBr3 sont un exemple de cette évolution. Le réseau, tridimensionnel dans le cas du fluorure de molybdène MoF3, dont l'anion F-, relativement petit, est peu polarisable, devient bidimensionnel dans le cas du chlorure de chrome trivalent CrCl3, dont l'anion Cl- est déja beaucoup plus polarisable ; le réseau de CrCl3 est formé par l'empilement de feuillets constitués d'ions Cr3+ entre deux couches d'ion Cl-. Le réseau du bromure d'aluminium AlBr3, dont l'anion Br- est encore plus volumineux, correspond cette fois à un empilement de molécules dimérisées Al2Br6 constituées de deux tétraèdres (AlBr4) présentant une arête commune. On notera l'évolution simultanée de la coordinence cationique, qui passe de six dans le réseau du fluorure à quatre dans celui du bromure.
Il apparaît ainsi que les cristaux purement ioniques ne constituent qu'une gamme très étroite de matériaux et qu'une classification en cristaux ioniques, covalents, moléculaires et métalliques semble beaucoup trop tranchée ; entre ces divers cas limites, tous les intermédiaires sont en effet possibles. La théorie du réseau ionique permet cependant d'apporter de nombreux et fructueux renseignements dans le cas de beaucoup d'entre eux.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Michel POUCHARD : docteur ès sciences, professeur de chimie à l'université de Bordeaux-I, membre de l'Institut
Classification
Médias
Autres références
-
ALUNS
- Écrit par Jean PERROTEY
- 1 634 mots
-
CÉSIUM
- Écrit par Roger NASLAIN
- 1 125 mots
- 3 médias
Le césium possède les propriétés chimiques caractéristiques des éléments de la famille des alcalins. Il est extrêmement réactif, se combinant avec les éléments électronégatifs pour donner des composés typiquement ioniques, solubles dans l'eau et qui constituent des électrolytes forts. -
CRISTAUX
- Écrit par Marc AUDIER et Michel DUNEAU
- 7 292 mots
- 2 médias
L'exemple le plus courant de ces structures est le sel de cuisine, ou chlorure de sodium, de formule NaCl. Les structures ioniques sont caractérisées par la présence de deux types d'atomes, A et B, dont l'un a tendance à s'ioniser positivement, en cédant un ou plusieurs électrons (A... -
MATIÈRE (physique) - État solide
- Écrit par Daniel CALÉCKI
- 8 631 mots
- 12 médias
Le prototype descristaux ioniques est le sel gemme, NaCl, qui appartient à la famille des halogénures alcalins (NaCl, KCl, CsCl, KBr, etc.). Ces cristaux sont obligatoirement construits à partir de deux atomes différents : un atome monovalent (ne possédant qu'un électron de valence faiblement lié),... - Afficher les 8 références