SULFATES NATURELS
Article modifié le
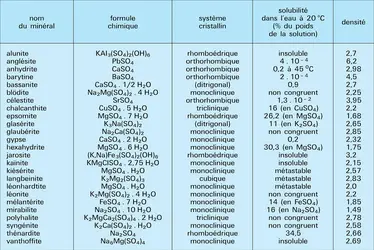
Les sulfates sont les sels de l'acide sulfurique (cf. acidesulfurique). Dans la nature, le groupe des sulfates compte de nombreuses espèces minéralogiques (plus de 200), parmi lesquelles un peu plus d'une vingtaine – dont le tableau donne les principales caractéristiques – ont une réelle importance géologique ou économique. Des considérations d'ordre physique et surtout cristallochimique ont conduit à réunir le groupe des sulfates et les groupes des chromates, molybdates et tungstates dans une classe minéralogique unique (cf. minéralogie, chap. 4). Dans ces minéraux, les anions forment des tétraèdres plus ou moins réguliers ; l'un des plans de symétrie des tétraèdres SO4-- (contenant le soufre et deux des oxygènes) peut également contenir le cation, ce qui confère à la plupart des sulfates anhydres une symétrie orthorhombique ; la symétrie devient généralement monoclinique dans les sulfates contenant des molécules d'eau.
Les sulfates naturels se forment dans des conditions variées : par condensation de fumerolles volcaniques, ils participent à la genèse des sublimés ; par altération des minerais sulfurés, ils apparaissent dans la zone d'oxydation des gîtes métallifères ; par précipitation directe, ils constituent une bonne part des gangues hydrothermales et des séries sédimentaires à « évaporites ».
Sulfates d'altération
Les sulfates d'altération proviennent surtout de l'oxydation des sulfures dans la frange supérieure de l'écorce terrestre. Lorsque l'érosion est assez faible pour que la zone d'oxydation se développe, tout dépôt métallifère exposé en surface est oxydé en un « chapeau de fer » où dominent des oxydes, des carbonates et des sulfates les moins solubles. C'est ainsi que la pyrite (FeS2) donne d'abord du sulfate ferreux FeSO4, puis du sulfate ferrique Fe2(SO4)3, instable dans les conditions habituelles où il se transforme en hydroxyde ferrique. En milieu sec, des solutions acides permettent le dépôt de sulfates de fer hydratés : plus de soixante-dix espèces d'identification délicate ont été décrites, la plus fréquente étant la jarosite (K,Na)Fe3(SO4)2(OH)6. Le sulfate ferrique et l'acide sulfurique jouent le rôle d'oxydant sur les autres sulfures et engendrent divers sulfates dont le comportement est régi par leurs solubilités respectives. Le moins soluble est l'anglésite PbSO4, qui se retrouvera dans toute l'épaisseur du « chapeau de fer ». Les plus solubles, comme le sulfate de zinc, percolent vers le bas et entrent dans des réactions nouvelles au voisinage de la zone de cémentation en fournissant du gypse (cf. infra) ainsi que des carbonates du métal correspondant (smithsonite dans le cas du zinc).
En climat aride, par contre, les solutions sont évaporées en surface et déposent de multiples espèces de sulfates plus ou moins hydratés comme, par exemple, la chalcanthite CuSO4 . 5H2O.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André JAUZEIN : professeur à la faculté des sciences de l'université de Paris-VI-Pierre-et-Marie-Curie, directeur du laboratoire de géologie de l'École normale supérieure de Paris
Classification
Médias
Autres références
-
ANHYDRITE
- Écrit par Yves GAUTIER
- 253 mots
Sulfate anhydre de calcium, l'anhydrite, fréquemment incolore ou blanche à grise, parfois bleutée à rosâtre, se présente généralement en masse finement cristallisée ou granulaire. Les cristaux bien exprimés (prismatiques courts et tabulaires) sont rares. On la reconnaît facilement grâce à ses trois...
-
BARYTINE
- Écrit par Yannick LOZAC'H
- 306 mots
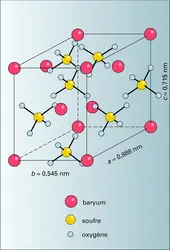
Sulfate de baryum (BaSO4) cristallisé dans le système orthorhombique. Les cristaux s'assemblent fréquemment en masses lamellaires, par suite du développement de la face (001) ; les cristaux prismatiques sont beaucoup plus rares. Le plus souvent, ce sont des amas granulaires, cryptocristallins....
-
BARYUM
- Écrit par Bernard CARTON
- 331 mots
Du grec barus, lourd
Symbole chimique : Ba
Numéro atomique : 56
Masse atomique : 137,34 g
Point de fusion : 725 0C
Point d'ébullition : 1 640 0C
Densité (à 20 0C) : 3,5.
Deuxième membre de la famille des alcalinoterreux (après le calcium), dont C. W. Scheele découvrit la base (baryte)...
-
CALCIUM
- Écrit par Jean PERROTEY
- 2 293 mots
- 2 médias
Lesulfate est lui aussi important, puisque, sous sa forme hydratée, il constitue le plâtre. Le gypse naturel est bihydraté ; chauffé à une température inférieure à 150 0C, il perd 1,5 molécule d'eau et, au-delà, le sulfate anhydre β se forme ; ces phases de la déshydratation étant réversibles,... - Afficher les 16 références
Voir aussi