SYNTHÈSE CHIMIQUE
Plan de synthèse
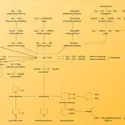
L'établissement du plan de synthèse d'une molécule complexe constitue un des défis intellectuels les plus excitants pour le chimiste organicien. Cet exercice demande beaucoup d'imagination, mais aussi une grande connaissance des réactions, des réactifs et substrats utilisables et de la sélectivité espérée pour chaque étape : chimiosélectivité (différenciation des groupements fonctionnels), régiosélectivité (attaque sélective des groupements fonctionnels) et stéréosélectivité. Pour préparer un plan de synthèse, on fait appel à la rétrosynthèse, qui consiste à disséquer la molécule cible en fragments de plus en plus simples, jusqu'aux substrats de départ facilement accessibles. On utilise la méthode de disconnexion des liaisons, en essayant d'imaginer, lors de la synthèse proprement dite, quelles seront les liaisons formées le plus facilement et le plus sélectivement. En raison de la multiplicité des solutions existant a priori, c'est lors de cette étude préliminaire que le chimiste devra exercer toute sa sagacité. Pour choisir la meilleure stratégie à adopter, il pourra toutefois s'appuyer sur quelques règles, parmi lesquelles : nécessité de bien reconnaître les intermédiaires clés qui pourront constituer des plaques tournantes pour la synthèse de cibles de structures voisines ; utilisation du minimum d'étapes, en privilégiant une synthèse convergente (construction indépendante d'éléments structuraux réunis aussi tard que possible) ; préférence donnée à un processus intramoléculaire permettant un meilleur contrôle stéréochimique plutôt qu'à un processus intermoléculaire. Dans de nombreux cas, la synthèse multistade a été à l'origine de découvertes et a contribué à de nouveaux développements, qu'il s'agisse de concepts (analyse conformationnelle, règles de Woodward-Hoffmann), de méthodes générales (photochimie, catalyse homogène, chimie radicalaire, biotransformation, assistance de l'ordinateur), de réactions (A. J. Birch, G. Wittig, H. C. Brown), de réactifs (issus de la chimie inorganique ou utilisant des éléments jusque-là peu utilisés tels que P, Si, B, Se), de conditions expérimentales (solvants aprotiques polaires basiques, éthers couronne et cryptates, catalyse par transfert de phase).
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean-Marie SURZUR : professeur de chimie, faculté des sciences de Marseille
Classification
Médias
Autres références
-
ACÉTALS
- Écrit par Jacques METZGER
- 866 mots
- 1 média
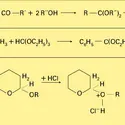
La méthode la plus générale de préparation des acétals d'aldéhydes et d'alcools primaires et secondaires est l'action d'une quantité catalytique d'acide chlorhydrique gazeux et sec sur une solution de l'aldéhyde dans un excès d'alcool. Cette synthèse échoue dans le cas des cétones pour... -
ACÉTYLACÉTIQUE ESTER
- Écrit par Jacques METZGER
- 1 356 mots
- 2 médias
La dihydropyridine (XII) ainsi obtenue, soumise à une hydrolyse acide et une oxydation (nitrique), donne finalement la triméthyl-2,4,6 pyridine (XIII, appelée couramment sym collidine). C'est la classique synthèse des pyridines de Hantzsch. -
ACÉTYLÈNE
- Écrit par Henri GUÉRIN
- 5 094 mots
- 6 médias
Lasynthèse de l'acétylène réalisée par Berthelot, en faisant éclater l'arc électrique dans de l'hydrogène (expérience classique de l'œuf électrique), n'a pas eu de conséquence pratique si ce n'est qu'elle a montré que l'acétylène formé à haute température devait être trempé (c'est-à-dire refroidi brusquement)... -
ALCALOÏDES
- Écrit par Jacques E. POISSON
- 5 689 mots
- 5 médias
Comme pour beaucoup de produits naturels, les édifices moléculaires des alcaloïdes sont assez complexes (strychnine, aconitine, ergotamine, etc.) et leur reconstitution représente pour les chimistes organiciens un défi qu'ils n'ont pas manqué de relever. À l'origine, il s'agissait surtout de vérifier... - Afficher les 79 références