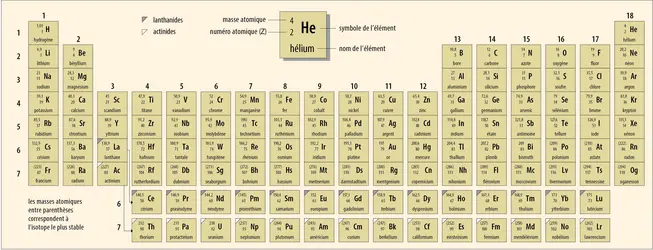
TABLEAU PÉRIODIQUE DES ÉLÉMENTS
Article modifié le
La classification périodique des éléments organise tous les éléments chimiques dans un tableau composé de dix-huit colonnes (ou groupes) et de sept lignes (ou périodes). Ils sont classés d’une part par numéro atomique (Z) croissant : un nombre entier, compris entre 1 et 118, qui indique le nombre de protons que compte chaque atome de l’élément et qui correspond également au nombre de ses électrons. D’autre part, ils sont répartis dans les colonnes en fonction de leur configuration électronique (répartition des électrons autour du noyau atomique) et donc de leurs propriétés physico-chimiques. Ainsi, les éléments appartenant à une même colonne possèdent la même couche électronique externe, c’est-à-dire le même nombre d’électrons périphériques, et donc des propriétés similaires ; ils forment une famille, comme celles des métaux alcalins, des métaux alcalino-terreux, des halogènes ou des gaz rares.
Connu dans le monde entier, le tableau périodique des éléments, publié dans une multitude de manuels de chimie et ornant nombre de murs de laboratoires et de salles de classe scientifique, a bien changé de visage depuis son invention. Sa première représentation est due au Russe Dmitri Ivanovitch Mendeleïev (1834-1907) en 1869, d’où le nom de tableau de Mendeleïev qui lui est aussi donné. À cette époque, seuls 63 éléments étaient connus. En décembre 2015, quatre nouveaux éléments chimiques ont été intégrés officiellement dans le tableau qui, devenu complet, en comporte donc bien 118 désormais.
De Lavoisier à Mendeleïev
Lorsque Mendeleïev, chimiste touche-à-tout de génie et visionnaire, aborde la question d’un classement logique des corps simples, nombreux sont les savants à s’être déjà penchés sur le problème depuis la fin du xviiie siècle. En 1789, le Français Antoine Laurent Lavoisier présente un tableau récapitulatif des « substances » considérées à son époque comme des éléments chimiques dans son Traité élémentaire de chimie. La détermination des masses atomiques sera ensuite essentielle pour le classement des éléments. En 1862, le géologue et minéralogiste français Alexandre-Émile Béguyer de Chancourtois est le premier à remarquer la périodicité des propriétés chimiques en fonction du poids des atomes. Il dispose les éléments sur un graphe qu’il appelle « vis tellurique » (en référence au tellure, l’élément central du graphe). Cette vis tellurique range les éléments en hélice sur un cylindre de telle sorte que ceux qui possèdent des propriétés similaires se situent l’un au-dessus de l’autre ; c’est la première ébauche de classification périodique des éléments. En 1864, le chimiste britannique John Alexander Reina Newlands met à plat le cylindre fictif portant l’hélice ; les éléments alors connus se classent en huit colonnes de sept lignes et leurs propriétés chimiques sont similaires au sein de chaque ligne, avec parfois deux éléments dans une même case. Enfin, entre 1864 et 1870, le chimiste allemand Julius Lothar Meyer travaille sur une classification où les éléments sont rassemblés en familles définies par leur valence (le nombre maximal de liaisons qu’un élément peut former en fonction de sa configuration électronique) : c’est un grand pas vers la forme moderne du tableau périodique ; les éléments sont organisés en groupes dépendant de leur configuration électronique, elle-même directement en relation avec leur valence.
À la fin des années 1860, c’est au tour de Mendeleïev de concevoir un tableau de classification où les éléments chimiques sont ordonnés par masse atomique croissante et montrent une périodicité de leurs propriétés physico-chimiques (d’où le nom de tableau périodique des éléments). Alors professeur de chimie minérale à Saint-Pétersbourg, il écrit, de 1868 à 1871, les Principes de chimie où l’on trouve[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Séverine BLÉNEAU-SERDEL
: docteure en spectrochimie, rédactrice en chef adjointe de
L'Actualité chimique
Classification
Médias
Autres références
-
ATOMIQUE PHYSIQUE
- Écrit par Philippe BOUYER et Georges LÉVI
- 6 652 mots
- 1 média
...capitale en physique car elle a permis d'énoncer tous les éléments pouvant exister dans la nature, et même de prévoir des atomes qui n'y existent pas. Elle a justifié a posteriori le tableau périodique des éléments établi en 1869 par Dmitri Mendeleïev. En effet, la capacité d'un atome à se lier à un... -
BOHR NIELS (1885-1962)
- Écrit par Léon ROSENFELD
- 3 115 mots
- 1 média
...polyatomiques (ces dernières comportant plusieurs noyaux). Ainsi, Bohr suggérait l'identification du numéro atomique, indiquant la place d'un élément dans le tableau périodique, avec le nombre des électrons périphériques, plus fondamental que la masse atomique des chimistes ; il en tirait même, sans les publier,... -
BOSONS ET FERMIONS
- Écrit par Bernard PIRE
- 1 709 mots
- 1 média
...Wolfgang Pauli (1900-1958) selon laquelle un état donné dans un système physique ne peut être occupé par plus d'une particule. Cette règle appliquée aux électrons d'un atome explique la structure du tableau de Mendeleïev, qui représente la classification périodique des éléments. -
MENDELEÏEV DMITRI IVANOVITCH (1834-1907)
- Écrit par René BIMBOT
- 2 163 mots
- 3 médias
...indices et si elle rétablit l'harmonie de sa classification. Il procède ainsi pour vingt-huit éléments sur soixante-trois, et le résultat est le premier tableau périodique (cf. supra). Les poids atomiques croissent régulièrement le long des colonnes, et les éléments de propriétés voisines apparaissent...
Voir aussi