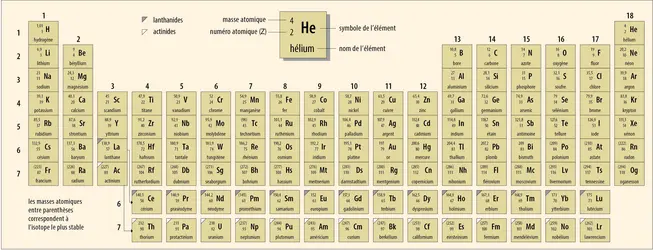
TABLEAU PÉRIODIQUE DES ÉLÉMENTS
L’intuition de Mendeleïev et les améliorations ultérieures

Tableau de Mendeleïev
Christophe Finot ; avec l’aimable permission de l’Université de Saint-Pétersbourg
À la différence de ses prédécesseurs, Mendeleïev formule explicitement en quoi son tableau constitue un outil d’analyse théorique des propriétés de la matière : « Les éléments chimiques, lorsqu’ils sont ordonnés par masse atomique croissante, montrent une périodicité de leurs propriétés chimiques. » Il est ainsi possible de prédire certaines propriétés des éléments à partir de leur masse atomique. Le génie de Mendeleïev est d’avoir pensé à intégrer d’avance dans le tableau plusieurs corps simples restant forcément à découvrir. Il laisse donc des cases vides pour pouvoir y insérer ces éléments inconnus – qu’il nomme eka, dvi et tri, « un », « deux » et « trois », en sanskrit, en fonction de leur place sous un élément déjà connu – dont il prédit les propriétés. Une fois trouvée, cette logique paraît évidente, même si elle résulte d’une longue réflexion !
Les découvertes du gallium (eka-aluminium) en 1875, du scandium (eka-bore) en 1879, et du germanium (eka-silicium) en 1886 convaincront les sceptiques. Notons qu’il faudra attendre 1937 pour que l’eka-manganèse, qui prendra le nom de technétium, soit séparé des produits de fission nucléaire de l’uranium. De nombreux corps simples ont trouvé leur place dans la classification périodique depuis et tous les éléments naturels ont fini par être découverts dans les années qui ont suivi l’élaboration de cette classification. En 1886 notamment, Henri Moissan réussit à isoler le fluor. William Ramsay découvre la série des gaz rares (dernière colonne du tableau) entre 1894 et 1898 ; il isole le radon en 1910. Pierre et Marie Curie amorcent quant à eux l’ère des éléments radioactifs avec la découverte du polonium en 1898. Le dernier élément naturel identifié sera le rhénium en 1925.
Pour la petite histoire, lorsque Mendeleïev met au point sa classification, l’existence des isotopes (atomes présentant le même nombre de protons et d’électrons mais pas le même nombre de neutrons) n’était pas encore établie, et le classement de Mendeleïev reflète deux inversions puisque la masse atomique du cobalt (58,93) est plus élevée que celle du nickel (58,69), de même que la masse du tellure (127,6) par rapport à celle de l’iode (126,9). Les travaux du physicien britannique Henry Gwyn Jeffreys Moseley apportent la solution en 1913 : on s’aperçoit que si l’on tient compte des propriétés chimiques des éléments naturels, ils ne doivent pas être classés selon les masses atomiques mais selon le nombre de charges contenues dans le noyau de l’atome (numéro atomique), nombre spécifique pour chaque élément.
Reconnu par ses pairs, Mendeleïev n’a pourtant jamais reçu le prix Nobel (en 1906, le comité Nobel lui préféra Henri Moissan). Un élément hautement radioactif identifié en 1955 a été baptisé en son honneur – le mendélévium (Md, élément 101) –, ainsi qu’un gros cratère situé sur la face cachée de la Lune.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Séverine BLÉNEAU-SERDEL
: docteure en spectrochimie, rédactrice en chef adjointe de
L'Actualité chimique
Classification
Médias
Autres références
-
ATOMIQUE PHYSIQUE
- Écrit par Philippe BOUYER et Georges LÉVI
- 6 652 mots
- 1 média
...capitale en physique car elle a permis d'énoncer tous les éléments pouvant exister dans la nature, et même de prévoir des atomes qui n'y existent pas. Elle a justifié a posteriori le tableau périodique des éléments établi en 1869 par Dmitri Mendeleïev. En effet, la capacité d'un atome à se lier à un... -
BOHR NIELS (1885-1962)
- Écrit par Léon ROSENFELD
- 3 115 mots
- 1 média
...polyatomiques (ces dernières comportant plusieurs noyaux). Ainsi, Bohr suggérait l'identification du numéro atomique, indiquant la place d'un élément dans le tableau périodique, avec le nombre des électrons périphériques, plus fondamental que la masse atomique des chimistes ; il en tirait même, sans les publier,... -
BOSONS ET FERMIONS
- Écrit par Bernard PIRE
- 1 709 mots
- 1 média
...Wolfgang Pauli (1900-1958) selon laquelle un état donné dans un système physique ne peut être occupé par plus d'une particule. Cette règle appliquée aux électrons d'un atome explique la structure du tableau de Mendeleïev, qui représente la classification périodique des éléments. -
MENDELEÏEV DMITRI IVANOVITCH (1834-1907)
- Écrit par René BIMBOT
- 2 163 mots
- 3 médias
...indices et si elle rétablit l'harmonie de sa classification. Il procède ainsi pour vingt-huit éléments sur soixante-trois, et le résultat est le premier tableau périodique (cf. supra). Les poids atomiques croissent régulièrement le long des colonnes, et les éléments de propriétés voisines apparaissent...