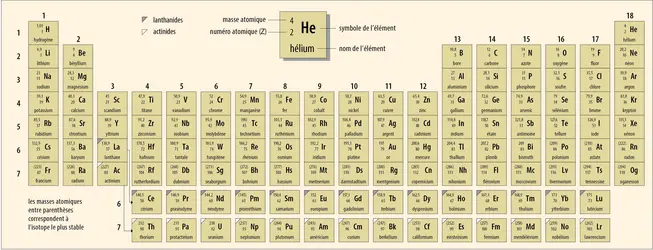
TABLEAU PÉRIODIQUE DES ÉLÉMENTS
Article modifié le
Un tableau désormais complet… jusqu’à preuve du contraire
Depuis 1937, avec la découverte du technétium (qui n’est pas considéré comme une substance naturelle même si on en a trouvé des traces en 1962 dans des échantillons de pechblende), ce sont des éléments artificiels (n’existant pas à l’état naturel sur Terre) qui font régulièrement leur entrée dans le tableau périodique des éléments. Les physiciens les obtiennent en provoquant des collisions de particules au sein de machines puissantes, les accélérateurs de particules. La plupart de ces éléments artificiels ont une très brève durée de vie (quelques fractions de seconde).
En décembre 2015, l’Union internationale de chimie pure et appliquée (International Union of Pure and Applied Chemistry ou IUPAC) – organisme scientifique mondial qui régit la nomenclature, la terminologie et la mesure de la chimie – a publié un communiqué confirmant l’entrée officielle de quatre nouveaux éléments au sein du tableau périodique, venant compléter sa septième ligne. Après avoir examiné les différents articles scientifiques publiés entre 2004 et 2012 décrivant ces nouveaux venus, l’IUPAC et son équivalent en physique – l’IUPAP (International Union of Pure and Applied Physics) – ont conclu que les critères de découverte des éléments 113, 115, 117 et 118 étaient remplis.
Ces quatre nouveaux éléments n’ont pas été faciles à découvrir. Dits « superlourds », ils sont instables et, pour les produire, les chimistes ont procédé par fusion nucléaire (processus qui associe deux noyaux atomiques légers pour former un noyau plus lourd). Leur durée de vie n’est que de quelques fractions de seconde avant qu’ils ne se désintègrent en d’autres éléments moins lourds (processus de fission nucléaire). La découverte de l’élément 113 – résultant du bombardement de noyaux de bismuth avec des ions de zinc – a été attribuée à une équipe de scientifiques de l’institut japonais Riken, dirigée par Kosuke Morita ; une première pour un pays asiatique. La découverte des trois autres éléments (115, 117 et 118) résulte quant à elle d’une collaboration entre l’Institut unifié de recherches nucléaires de Doubna (Russie) et les laboratoires américains de Lawrence Livermore (Californie) et d’Oak Ridge (Tennessee). Pour les produire, les chimistes ont bombardé des atomes de curium et de plutonium avec des ions calcium. Les chercheurs à l’origine de ces quatre découvertes ont proposé de les nommer :
– Nihonium, de symbole Nh, pour l’élément 113, dérivé d'un terme qui signifie « la Terre du Soleil levant » en japonais ;
– Moscovium, de symbole Mc, pour l’élément 115, faisant référence à son lieu de découverte près de Moscou ;
– Tennesse, de symbole Ts, pour l’élément 117, pour rappeler le laboratoire d’Oak Ridge dans le Tennessee, point de départ de sa fabrication ;
– Oganesson, de symbole Og, pour l’élément 118, en hommage à Yuri Oganessian, physicien russe pionnier dans la recherche des nouveaux éléments qualifiés de superlourds.
Ces noms ont été définitivement acceptés par l’IUPAC en novembre 2016. Avant cela, ces éléments avaient été appelés provisoirement par leur traduction en latin : ununtrium (symbole Uut) pour l’élément 113, ununpentium (Uup) pour l’élément 115, ununseptium (Uus) pour l’élément 117 et ununoctium (Uuo) pour l’élément 118.
Le tableau périodique actuel, qui a connu plusieurs retouches par rapport au tableau proposé par Mendeleïev (notamment l’ajout des lignes des actinides et des lanthanides, et de la colonne des gaz rares), est donc complet… jusqu’à preuve du contraire. En effet, depuis les années 1960, les scientifiques spéculent sur l’existence d’une huitième ligne et même au-delà, jusqu’à l’élément 160. Ils espèrent atteindre un « îlot de stabilité » formé d’éléments qui auraient[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Séverine BLÉNEAU-SERDEL
: docteure en spectrochimie, rédactrice en chef adjointe de
L'Actualité chimique
Classification
Médias
Autres références
-
ATOMIQUE PHYSIQUE
- Écrit par Philippe BOUYER et Georges LÉVI
- 6 652 mots
- 1 média
...capitale en physique car elle a permis d'énoncer tous les éléments pouvant exister dans la nature, et même de prévoir des atomes qui n'y existent pas. Elle a justifié a posteriori le tableau périodique des éléments établi en 1869 par Dmitri Mendeleïev. En effet, la capacité d'un atome à se lier à un... -
BOHR NIELS (1885-1962)
- Écrit par Léon ROSENFELD
- 3 115 mots
- 1 média
...polyatomiques (ces dernières comportant plusieurs noyaux). Ainsi, Bohr suggérait l'identification du numéro atomique, indiquant la place d'un élément dans le tableau périodique, avec le nombre des électrons périphériques, plus fondamental que la masse atomique des chimistes ; il en tirait même, sans les publier,... -
BOSONS ET FERMIONS
- Écrit par Bernard PIRE
- 1 709 mots
- 1 média
...Wolfgang Pauli (1900-1958) selon laquelle un état donné dans un système physique ne peut être occupé par plus d'une particule. Cette règle appliquée aux électrons d'un atome explique la structure du tableau de Mendeleïev, qui représente la classification périodique des éléments. -
MENDELEÏEV DMITRI IVANOVITCH (1834-1907)
- Écrit par René BIMBOT
- 2 163 mots
- 3 médias
...indices et si elle rétablit l'harmonie de sa classification. Il procède ainsi pour vingt-huit éléments sur soixante-trois, et le résultat est le premier tableau périodique (cf. supra). Les poids atomiques croissent régulièrement le long des colonnes, et les éléments de propriétés voisines apparaissent...
Voir aussi