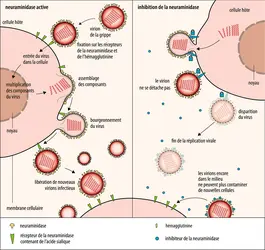
TAMIFLU ou PHOSPHATE D'OSELTAMIVIR
Article modifié le
Des conflits d'intérêts
En clair, la présentation initiale et largement acceptée des effets du Tamiflu® a fonctionné comme un verre grossissant des seuls aspects bénéfiques. Cette conclusion est particulièrement importante pour le Japon, où cette molécule fait partie de la stratégie de santé publique contre les grippes annuelles, alors qu'ailleurs, en France en particulier, il s'agit plutôt d'une précaution dans le cas d'une pandémie inattendue. D'autres études, et surtout d'autres molécules, car l'hypothèse pharmaceutique à l'origine de la conception des inhibiteurs de la neuraminidase virale reste une piste intéressante, devront être produites. En France, le médicament n'est plus remboursé qu'à 30 p. 100, et il est réservé à un petit nombre d'indications.
Plusieurs raisons expliquent le passage du triomphalisme au doute. De nombreux conflits d'intérêts parmi les universitaires ont été relevés, en particulier par les commentateurs médiatiques de l'analyse de Tom Jefferson. Tous ne concernaient pas des experts. Par exemple, l'accord de la Food and Drug Administration américaine a été donné en octobre 1999. Il se trouve que, avant de devenir secrétaire d'État à la Défense de George W. Bush, Donald Rumsfeld fut, de 1997 à 2001, président du conseil d'administration de la société Gilead inventrice du Tamiflu®, et possédait encore en 2005 des actifs de cette société évalués à 17 millions de dollars alors que l'armée américaine avait acheté des millions de doses du médicament. Ici encore, les conflits d'intérêts ne sont pas chose nouvelle et devraient être – en principe – évitables.
Le point essentiel est que des conclusions importantes quant à l'utilité d'un médicament et ses indications ont été tirées alors qu' une large part des données d'essais cliniques n'ont pas été publiées et ne le sont toujours pas. Ces essais sont par ailleurs souvent mentionnés ou cautionnés par des auteurs ou des décideurs alors qu'ils n'ont pas pu en prendre connaissance ! Des décisions nationales et internationales ont été prises, comme celle de l'achat en masse ruineux de Tamiflu®, finalement en toute méconnaissance de cause, sur la base de conclusions tirées d'un sous-ensemble sélectionné de données. Le biais dans le choix des informations est une chose connue, mais on ne peut l'identifier que si on compare les informations choisies à l'ensemble des autres. Or de nombreuses informations n'ont pas été fournies aux épidémiologistes.
Deux phénomènes dangereux quant à la santé publique deviennent ici patents, qui appellent chacun une réponse. L'un concerne la chaîne du traitement de l'information qui aboutit in fine à la mise sur le marché d'un médicament : il est clair que, passé un stade initial d'approbation, on se contente d'entériner et de propager cette conclusion antérieure sans examen approfondi. L'autre est la nécessité absolue, pour des raisons de déontologie médicale et tout simplement d'honnêteté, de publier l'ensemble des résultats des essais cliniques, qu'ils soient positifs, négatifs ou neutres. Cet aspect dépasse largement le seul cas des inhibiteurs de la neuraminidase. Il implique aussi bien les chercheurs que les éditeurs de journaux ou de sites Internet, tous peu enclins à publier des résultats négatifs. Ce problème est mis en avant dans l'éditorial du 9 janvier 2013 du British Medical Journal, un journal qui, avec la Cochrane Collaboration et la James Lind Library d'Oxford, est ainsi le fer de lance de l'exigence d'une transparence complète de la part de l'industrie pharmaceutique. L'absence de transparence des essais cliniques est probablement un des scandales sanitaires les plus importants des dernières décennies.[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Gabriel GACHELIN : chercheur en histoire des sciences, université Paris VII-Denis-Diderot, ancien chef de service à l'Institut Pasteur
Média
Voir aussi