VIDE TECHNIQUE DU
Lois générales de l'état raréfié
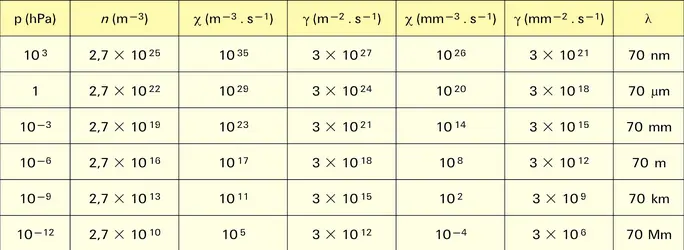
Lorsque N molécules de gaz parfait sont enfermées dans un réservoir de volume V, la pression p est donnée par l'équation d'état pV = NkT, avec p exprimé en pascals (Pa), V en mètres cubes (m3) et T, la température, en kelvins (K) ; k est la constante de Boltzmann et vaut 1,38 × 10−23 JK−1. L'équation ci-dessus est d'autant mieux vérifiée que la taille des molécules est négligeable devant la distance qui les sépare, ce qui est la situation naturelle de l'état raréfié. On utilise souvent cette relation sous la forme p = nkT, où n, la densité moléculaire, est égale à N/V. En appliquant l'hypothèse d'Avogadro, on détermine aisément que n vaut 2,69 × 1025 molécules par mètre cube dans les conditions normales de température et de pression (soit respectivement 273,15 K et 101 325 Pa).
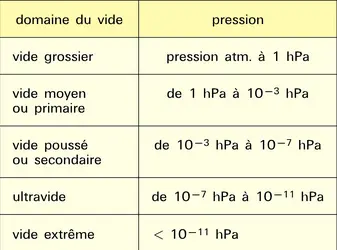
Faire le vide consiste à diminuer n. Pour s'assurer de cette baisse, on mesure p et, au besoin, T quand cette dernière change de manière significative. Un certain nombre de résultats indispensables pour mettre en œuvre la technique du vide proviennent de la théorie cinétique des gaz édifiée par James Clerk Maxwell et Ludwig Boltzmann. L'état gazeux y est représenté par une vaste population de molécules, parfaitement élastiques, en mouvement perpétuel les unes par rapport aux autres sous l'effet de l'agitation thermique. Il n'y a pas de direction privilégiée ni d'influence de champ de quelque nature que ce soit. Les seules interactions possibles sont des collisions binaires, obéissant aux lois de la mécanique classique. Chaque collision modifie la vitesse et la direction de propagation des molécules impliquées, mais l'énergie cinétique et la quantité de mouvement sont conservées. L'énergie cinétique totale contenue dans le gaz est donc constante. L'état ainsi décrit est appelé chaos moléculaire. À l'échelle macroscopique, en tout endroit, le milieu présente les mêmes propriétés observables. La phase gazeuse est unique, isotrope, expansible à l'infini. La distance moyenne franchie par une molécule entre deux collisions successives s'appelle le libre parcours moyen (λ). Il est évidemment rectiligne, couvert à vitesse uniforme et s'allonge quand la pression diminue. Il vaut λ = 1/π√2σ2n, où σ est le diamètre de la molécule. Le libre parcours moyen est un repère fondamental de la technique du vide. En pratique, on utilise une relation calculée pour le diazote, choisi comme gaz de référence : λ = 6,65 × 10−3/p, où λ est exprimé en centimètres et p en hectopascals.
Il faut distinguer la rencontre de deux molécules, que nous avons baptisée collision, de la rencontre entre une molécule et la paroi du réservoir, que nous nommerons choc. Si l'on assimile la paroi à une molécule de masse très grande, il ne peut pas y avoir transmission d'énergie. Le choc ne fait que retourner la composante de vitesse perpendiculaire à la paroi comme s'il s'agissait d'une réflexion spéculaire. En d'autres termes, la température du gaz et la température de la paroi sont indépendantes l'une de l'autre. Dans la réalité, on vérifie évidemment le contraire, mais, comme c'est une hypothèse qui conserve la symétrie du modèle puisque la répartition des vitesses n'est pas perturbée et qu'aucune direction n'est privilégiée, il est légitime de l'admettre. Le calcul donne respectivement le nombre de collisions (χ) par unité de temps et unité de volume et le nombre de chocs (γ) par unité de temps et unité de surface. On a ainsi : χ = 0,5 n2π√2σ2vm et γ = nvm/4, où vm, la vitesse moyenne des molécules, est égale à (8 kT/πm)0,5, m étant la masse réelle de la molécule. On utilise aussi la relation numérique[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre AILLOUD : docteur en métallurgie, ingénieur au Centre national de la recherche scientifique, président de la commission enseignement à la Société française du vide
Classification
Médias
Autres références
-
EXPERIMENTA MAGDEBURGICA DE VACUO SPATIO (O. von Guericke)
- Écrit par Bruno JACOMY
- 534 mots
- 1 média
En 1672 paraît à Amsterdam un ouvrage de 250 pages intitulé Experimenta nova (ut vocantur) Magdeburgica de vacuospatio(Expériences nouvelles dites de Magdebourg sur l’espace vide). L’auteur, Otto von Guericke (1602-1686), est un physicien, ingénieur et homme politique allemand, considéré...
-
GEISSLER HEINRICH (1815-1879)
- Écrit par Georges KAYAS
- 338 mots
Mécanicien et physicien allemand, né à Igelshied (Thuringe) et mort à Bonn. Fils d'un souffleur de verre, Heinrich Geissler apprit lui-même ce métier dans le duché de Saxe-Werningen et l'exerça dans plusieurs universités allemandes, parmi lesquelles l'université de Munich....
-
GETTER
- Écrit par Jean-Pierre LÉVIS
- 197 mots
Pastilles de métaux oxydables (on utilise fréquemment les métaux alcalins ou alcalino-terreux) que l'on introduit dans les tubes électroniques au moment de la mise en place des électrodes et qui permettent de parfaire le vide dans les tubes. Le métal du getter est coulé dans une coupelle métallique...
-
GUERICKE OTTO VON (1602-1686)
- Écrit par Bruno JACOMY et Jacques MÉRAND
- 525 mots
- 1 média
Physicien et homme politique allemand, Otto von Guericke s’est illustré par ses travaux sur le vide et les effets de la pression atmosphérique, ainsi que par la mise au point de la première machine électrostatique.
Né le 20 novembre 1602 à Magdebourg, Otto von Guericke, après des études...
- Afficher les 16 références