CINÉTIQUE DES FLUIDES THÉORIE
Article modifié le
Fonctions de distribution des vitesses
Les molécules constituant un gaz sont animées à tout instant de mouvements désordonnés qui constituent ce qu'on appelle l'agitation thermique. La description fine d'un gaz doit donc tenir compte de cet état microscopique ; cependant un petit volume de gaz contient toujours en pratique un très grand nombre de molécules (1mm3 d'air dans les conditions normales contient 2,7 . 1016 molécules) ; c'est pourquoi, pour décrire l'état microscopique du gaz, on doit se contenter d'expressions statistiques qu'on appelle les fonctions de distribution des vitesses et qui sont les grandeurs de base de la théorie cinétique des gaz.
Fonction de distribution simple
À un instant donné, le mouvement d'une molécule du gaz peut être caractérisé par son vecteur position r et son vecteur vitesse w. On représente la position par un point dans l'espace ordinaire et le vecteur vitesse par un point dans l'espace des vitesses. Dans chacun de ces deux espaces, on considère alors deux petits éléments de volume dr− = dx dy dz et dw− = dwxdwydwz, centrés respectivement autour des valeurs moyennes r et w de la position ou de la vitesse. On désigne par <dN> le nombre probable de molécules du gaz dont les points représentatifs sont dans dr−, en ce qui concerne la position, et dans dw−, en ce qui concerne la vitesse ; ce nombre est évidemment proportionnel à dr− et dw− et l'on posera par définition :

– stationnaire, si elle ne dépend pas de t ;
– homogène, si elle ne dépend pas de r ;
– isotrope, si elle ne dépend que du module de w et non de son orientation.
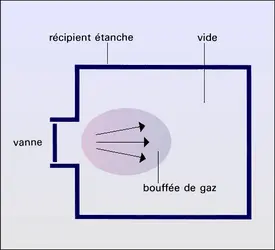
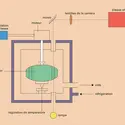
La figure représente un cas de distribution instationnaire, inhomogène, anisotrope obtenue par l'injection d'une bouffée de gaz dans un récipient préalablement vidé.
En pratique, on applique généralement la relation de définition (13) à des éléments de volume qui, tout en étant petits à l'échelle macroscopique, sont encore assez grands pour contenir un grand nombre de molécules. Dans ces conditions, la loi des grands nombres permet d'affirmer que le nombre réel dN de molécules contenues dans ces éléments de volume est voisin du nombre probable <dN> et l'on omet alors dans (13) le signe <>. Quoi qu'il en soit, la fonction de distribution simple permet de calculer presque toutes les grandeurs macroscopiquement mesurables (densité, vitesse de fluide, pression cinétique, taux de réactions physico-chimiques...).
Fonction de distribution double
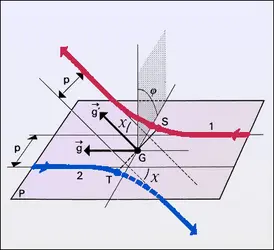
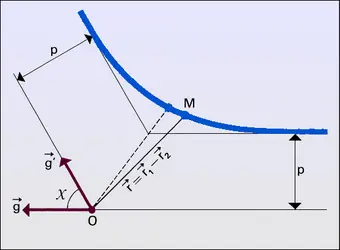
Pour l'étude de certaines propriétés des gaz, on a besoin de connaître les corrélations binaires entre deux points 1 et 2, c'est-à-dire de savoir dans quelle mesure ce qui se passe au point 1 est affecté par ce qui se passe au point 2 et réciproquement. Considérant donc deux points 1 et 2, définis par leurs positions r1, w1 et r2, w2 dans l'espace ordinaire (espace des positions) et dans l'espace des vitesses, on leur associe de petits éléments de volume dr−1, dw−1, dr−2, dw−2 centrés respectivement sur r1, w1 et r2, w2. Cela étant, on désigne par <dN2> le nombre probable de couples de particules dont les points représentatifs sont dans dr−1dw−1 pour la première particule du couple, et dans dr2 dw2 pour la deuxième, et on pose par définition :
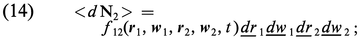
Lorsque les points 1 et 2 sont suffisamment[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean-Loup DELCROIX : Professeur à l'Université de Paris-Sud Orsay. Directeur de l'Ecole Supérieure d'Electricité.
Classification
Médias
Autres références
-
AXIOMATIQUE
- Écrit par Georges GLAESER
- 2 037 mots
...surfaces, etc. ; de plus, on décrit les constructions géométriques qui symbolisent, par exemple, les phénomènes de réflexion ou de réfraction. Dans la théorie cinétique des gaz, la théorie mathématique utilisée est relative au comportement statistique d'un grand nombre de « molécules » ; les axiomes... -
CAVITATION
- Écrit par Serge BINDEL
- 842 mots
Ébullition d'un liquide sous vide, donc généralement à température ordinaire ; ce vide peut être produit statiquement (par un émetteur d'ultrasons, par exemple) mais plus fréquemment au sein d'un écoulement, notamment dans les circuits hydrauliques, dans les machines hydrauliques (pompes,...
-
CENTRIFUGATION
- Écrit par Jean LEMERLE
- 1 797 mots
- 3 médias
Lorsque la décantation de particules sous l'effet du champ de pesanteur est inefficace ou trop lente, on a alors recours au procédé de centrifugation. Pour cela, on substitue au champ de pesanteur terrestre un champ de forces centrifuges infiniment plus grand, soit de 500 000 à 1 million de fois l'accélération...
-
CHALEUR
- Écrit par Paul GLANSDORFF
- 985 mots
La première tentative d'interprétation physique assimilait la chaleur à un fluide dit subtil et indestructible dénommé le calorique, répandu partout au sein de la matière. Son passage d'un corps à un autre était notamment responsable du refroidissement du premier et de l'échauffement du second....
- Afficher les 16 références
Voir aussi
- GAZ DIATOMIQUES
- GAZ POLYATOMIQUES
- ONDE DE CHOC
- RELAXATION, physique
- PRESSION, physique
- LIQUIDE ÉTAT
- TENSEURS
- LIBRE PARCOURS MOYEN
- PHASES ESPACE DES
- VITESSE
- COULOMB POTENTIEL DE
- COLLISION, physique
- COLLISIONS ÉLASTIQUES
- ÉQUILIBRE THERMODYNAMIQUE
- ÉQUIPARTITION DE L'ÉNERGIE
- CINÉTIQUES ÉQUATIONS
- BBGKY (Born, Bogolioubov, Green, Kirkwood, Yvon) SYSTÈME
- MOLÉCULES DIATOMIQUES
- DISTRIBUTION FONCTION DE
- LIOUVILLE ÉQUATION DE
- HIÉRARCHIE ÉQUATIONS DE LA
- MAXWELL-BOLTZMANN DISTRIBUTION DE
- GIBBS FORMULE DE
- COLLISIONS INÉLASTIQUES
- GAZ PARFAITS LOI DES
- FRÉQUENCE DE COLLISION
- HYDRODYNAMIQUE
- MOLÉCULES POLYATOMIQUES
- PLASMAS
- SECTION EFFICACE
- COLLISIONS SUPERÉLASTIQUES
- RÉGIMES, physique
- MASSE RÉDUITE
- PARAMÈTRE D'IMPACT
- THERMIQUE AGITATION
- VIBRATION MOLÉCULAIRE ÉNERGIE DE
- IONISÉS MILIEUX
- ÉNERGIE POTENTIELLE
- LOGARITHME COULOMBIEN
- GAZEUX ÉTAT
- BOLTZMANN ÉQUATION DE
- APPROXIMATION
- ÉNERGIE CINÉTIQUE
- ÉVOLUTION ÉQUATIONS D'
- TRANSPORT ÉQUATION DE