THERMODYNAMIQUE Lois fondamentales
Article modifié le
Le principe d'équivalence des unités de chaleur et de travail est généralement attribué au médecin allemand J. R. von Mayer, qui l'a formulé pour la première fois en 1842 dans ses Remarques sur les forces inanimées de la nature. Mais on doit aussi associer à la même découverte le nom de J. P. Joule avec, comme précurseurs, B. Thompson (comte Rumford, 1753-1814) et, semble-t-il aussi, Sadi Carnot (1796-1832), connu surtout pour sa contribution fondamentale au second principe.
Le premier principe
Pour un système fermé, le principe d'équivalence conduit à l'expression générale suivante du premier principe (dans un système unifié d'unités) :

La quantité U2 − U1 correspond à l'accroissement de l'énergie U du système entre l'état initial 1 et l'état final 2. La quantité Q est la chaleur reçue par le système, et W est le travail fourni au milieu extérieur.
L'énergie U se présente donc comme une fonction d'état, et le premier principe de la thermodynamique exprime dans sa généralité une propriété de conservation de cette énergie, car, pour un système isolé du monde extérieur, on a Q = 0 et W = 0, ce qui entraîne U1 = U2. D'où le nom de principe de la conservation de l'énergie, dont l'adoption revient à admettre l'impossibilité d'un moteur perpétuel et exige, en outre, l'abandon du vieux concept de calorique (cf. thermodynamique - Histoire).
Il est souvent commode de disposer de la forme différentielle du premier principe en vue de son application aux transformations infinitésimales. On écrit dans ce cas :
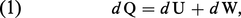
Il faut cependant souligner que, dans cette formulation, seule la quantité dU représente une différentielle exacte des variables décrivant l'état du système.
Dans le cas particulier d'un fluide à pression p uniforme, le travail élémentaire dW se réduit au produit pdV et l'énergie totale U, à l'énergie interne E en l'absence d'énergie cinétique. Le principe de conservation de l'énergie prend alors la forme simplifiée usuelle :
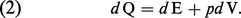
L'étude des transformations qui s'effectuent à volume V constant, appelées aussi isomètres ou encore isochores (dV = 0), permet d'introduire la notion de capacité thermiqueà volume constant sous la forme :

Lorsque la quantité de chaleur envisagée se rapporte à l'unité de masse ou à la mole, la capacité calorifique correspondante prend respectivement le nom de chaleur massique (anciennement chaleur spécifique), et de chaleur molaire.
On procède de même pour les transformations à pression constante appelées isobares (dp = 0). À cette fin, on introduit dans le principe de la conservation de l'énergie la fonction d'état H = E + pV, appelée enthalpie du système, ce qui permet d'écrire la relation (2) sous la forme :
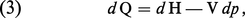
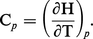
Les capacités thermiques Cp et CV sont donc aussi des fonctions d'état. Elles dépendent en général de la température, de la pression et de la composition du système. Pour un gaz parfait à un seul constituant, Cp et CV ne dépendent que de la température (loi de Joule). Au point de vue macroscopique, un gaz parfait est défini comme un système (p, V) obéissant aux lois de Joule et de Mariotte (loi de Boyle, 1662 ; loi de Mariotte, 1676) : À température constante, le volume d'une masse donnée d'un gaz parfait varie en raison inverse de sa pression : pV = constante.
Une transformation à température constante porte le nom d'isotherme. L'isotherme d'un gaz parfait est donc représentée par un arc d'hyperbole équilatère dans un système d'axes[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Paul GLANSDORFF : professeur émérite de la faculté des sciences à l'université de Bruxelles, président d'honneur de l'Institut international du froid, membre de l'Académie royale
- Ilya PRIGOGINE
: directeur des Instituts internationaux de physique et de chimie, fondés par Ernest Solvay à Bruxelles,
Ashbel Smith regental professor , université du Texas à Austin, directeur du Ilya Prigogine Center of Studies in Statistical Mechanics and Complex Systems, université du Texas à Austin
Classification
Médias
Autres références
-
THERMODYNAMIQUE (notions de base)
- Écrit par Bernard DIU
- 6 036 mots
De nos jours, on peut définir la thermodynamique comme la science des propriétés et des processus qui mettent en jeu la température et la chaleur.
Le nom de « thermodynamique » associe les deux mots grecs thermon (chaleur) et dynamis (puissance). Le but premier de la discipline, explicitement...
-
BOLTZMANN LUDWIG (1844-1906)
- Écrit par Pierre COSTABEL
- 1 636 mots
- 1 média
À partir de ce deuxième principe, Loschmidt a présenté à Boltzmann une objection redoutable, souvent reprise depuis lors, et qui consiste à affirmer l'impossibilité de faire sortir des équations réversibles de la mécanique une interprétation des processus irréversibles de la thermodynamique. Boltzmann... -
CARNOT SADI (1796-1832)
- Écrit par Robert FOX
- 841 mots
- 1 média
Fils aîné de Lazare Carnot, « l'Organisateur de la Victoire », Nicolas Léonard Sadi Carnot est un des pionniers de la thermodynamique. Son unique publication, les Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance, ignorée de son temps...
-
CHALEUR
- Écrit par Paul GLANSDORFF
- 985 mots
La première tentative d'interprétation physique assimilait la chaleur à un fluide dit subtil et indestructible dénommé le calorique, répandu partout au sein de la matière. Son passage d'un corps à un autre était notamment responsable du refroidissement du premier et de l'échauffement du second....
-
CLAUSIUS RUDOLF (1822-1888)
- Écrit par Robert FOX
- 1 001 mots
Rudolf Julius Emanuel Clausius, l'un des plus grands physiciens du xixe siècle, est connu principalement pour sa contribution à l'étude de la thermodynamique. Le premier, ce savant allemand formula ce qu'on a coutume d'appeler le deuxième principe et proposa une définition claire de l'...
- Afficher les 39 références
Voir aussi
- ISOBARE
- ÉNERGIE INTERNE
- CHALEUR MASSIQUE ou CHALEUR SPÉCIFIQUE
- CLAPEYRON FORMULE DE
- CLAPEYRON DIAGRAMME DE
- GIBBS FORMULE DE
- GAZ PARFAITS LOI DES
- ISOTHERME
- LAPLACE LOIS DE
- ÉNERGIE CONSERVATION DE L'
- CLAPEYRON ÉMILE (1799-1864)
- THERMODYNAMIQUE CHIMIQUE
- POTENTIEL CHIMIQUE
- THERMODYNAMIQUE PRINCIPES DE LA
- POTENTIEL THERMODYNAMIQUE ou MASSIEU FONCTION DE
- ENTHALPIE
- CARNOT CYCLE DE
- FONCTION D'ÉTAT, thermodynamique
- TRAVAIL, physique
- TEMPÉRATURE
- ÉNERGIE LIBRE DE HELMHOLTZ
- ÉQUILIBRE THERMODYNAMIQUE LOCAL
- ISOCHORE
- JOULE LOIS DE, thermodynamique
- BOYLE-MARIOTTE LOI DE
- GIBBS-DUHEM FORMULE DE
- GIBBS-HELMHOLTZ FORMULES DE
- NERNST HYPOTHÈSE DE
- ENTHALPIE LIBRE ou ÉNERGIE LIBRE DE GIBBS
- ADIABATIQUE TRANSFORMATION
- CARNOT-CLAUSIUS PRINCIPE DE
- CAPACITÉ CALORIFIQUE
- DE DONDER THÉOPHILE (1872-1957)
- ÉVOLUTION PRINCIPE D', thermodynamique
- ÉCHELLE THERMOMÉTRIQUE
- TRANSFORMATIONS THERMODYNAMIQUES
- TRANSFORMATION RÉVERSIBLE
- SYSTÈMES FERMÉS, thermodynamique