THERMODYNAMIQUE Lois fondamentales
Le second principe
Le second principe de la thermodynamique trouve son origine dans le célèbre mémoire de Sadi Carnot intitulé Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance, publié à Paris, en 1824.
Toutefois, comme il s'y trouvait exposé dans l'ancien langage du calorique, il a fallu toute la perspicacité de E. Clapeyron et de W. Thomson (lord Kelvin) pour le redécouvrir dans l'œuvre originale, au cours des années 1834 pour le premier, et 1848-1849 pour le second.
Développant quelques considérations relatives aux cycles, établies par Carnot à partir de l'impossibilité du mouvement perpétuel de seconde espèce (il est impossible de décrire un cycle direct à l'aide d'une seule source de chaleur), lord Kelvin établit l'échelle thermodynamique absolue de température T qui porte aujourd'hui son nom. Il prouve en même temps l'existence du zéro absolu, le même pour tous les corps (− 273,15 0C), et obtient pour le gaz parfait l'équation caractéristique simple :
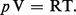
Partant de ces résultats, Clausius en a déduit, en 1850, une formulation mathématique du second principe si générale que, depuis cette époque, on lui a donné le nom de principe de Carnot-Clausius. Il montre d'abord que, pour l'ensemble des processus réversibles, la température T est un diviseur intégrant de dQ et que, par conséquent, on peut écrire, pour un système fermé à température uniforme, une égalité du type suivant :

Portant ensuite son attention sur les transformations irréversibles d'un système fermé et utilisant le résultat ci-dessus Clausius en déduit l'inégalité fondamentale suivante des processus irréversibles :
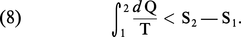
Pour obtenir cette dernière relation, il doit cependant admettre l'existence d'au moins une transformation réversible permettant de relier l'état initial et l'état final. Enfin, pour une transformation infinitésimale, il déduit directement des relations (7) et (8) l'inégalité différentielle, aujourd'hui classique :

En vue de l'extension des relations ci-dessus aux systèmes ouverts, il est commode d'exprimer le second principe sous la forme d'un bilan. Parallèlement au bilan d'énergie (4), on écrit le bilan entropique sous la forme :
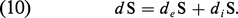
Le terme deS représente la contribution du milieu extérieur à l'accroissement d'entropie ; c'est le flux entropique reçu par le système. Il se réduit à dQ/T pour un système fermé à température uniforme. Quant au terme de source diS il correspond à l'accroissement d'entropie engendré par les processus irréversibles internes.
Le second principe impose un signe non négatif à cette source. Rapportée à l'unité de temps, on l'appelle généralement la production d'entropie :

Pour un système isolé, l'état d'équilibre correspond à un maximum de l'entropie. Toutefois, dans tous les cas, il correspond au minimum de la production d'entropie. Comme on le constatera plus loin, les états stationnaires de non-équilibre relevant du domaine de la thermodynamique linéaire possèdent cette même dernière propriété, mais alors le minimum n'est plus nul.
Dans le cas simple du milieu homogène dont l'état est entièrement défini par deux variables indépendantes,[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Paul GLANSDORFF : professeur émérite de la faculté des sciences à l'université de Bruxelles, président d'honneur de l'Institut international du froid, membre de l'Académie royale
- Ilya PRIGOGINE
: directeur des Instituts internationaux de physique et de chimie, fondés par Ernest Solvay à Bruxelles,
Ashbel Smith regental professor , université du Texas à Austin, directeur du Ilya Prigogine Center of Studies in Statistical Mechanics and Complex Systems, université du Texas à Austin
Classification
Médias
Autres références
-
THERMODYNAMIQUE (notions de base)
- Écrit par Bernard DIU
- 6 036 mots
De nos jours, on peut définir la thermodynamique comme la science des propriétés et des processus qui mettent en jeu la température et la chaleur.
Le nom de « thermodynamique » associe les deux mots grecs thermon (chaleur) et dynamis (puissance). Le but premier de la discipline, explicitement...
-
BOLTZMANN LUDWIG (1844-1906)
- Écrit par Pierre COSTABEL
- 1 636 mots
- 1 média
À partir de ce deuxième principe, Loschmidt a présenté à Boltzmann une objection redoutable, souvent reprise depuis lors, et qui consiste à affirmer l'impossibilité de faire sortir des équations réversibles de la mécanique une interprétation des processus irréversibles de la thermodynamique. Boltzmann... -
CARNOT SADI (1796-1832)
- Écrit par Robert FOX
- 841 mots
- 1 média
Fils aîné de Lazare Carnot, « l'Organisateur de la Victoire », Nicolas Léonard Sadi Carnot est un des pionniers de la thermodynamique. Son unique publication, les Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance, ignorée de son temps...
-
CHALEUR
- Écrit par Paul GLANSDORFF
- 985 mots
La première tentative d'interprétation physique assimilait la chaleur à un fluide dit subtil et indestructible dénommé le calorique, répandu partout au sein de la matière. Son passage d'un corps à un autre était notamment responsable du refroidissement du premier et de l'échauffement du second....
-
CLAUSIUS RUDOLF (1822-1888)
- Écrit par Robert FOX
- 1 001 mots
Rudolf Julius Emanuel Clausius, l'un des plus grands physiciens du xixe siècle, est connu principalement pour sa contribution à l'étude de la thermodynamique. Le premier, ce savant allemand formula ce qu'on a coutume d'appeler le deuxième principe et proposa une définition claire de l'...
- Afficher les 39 références