THERMODYNAMIQUE Processus irréversibles non linéaires
Transitions de non-équilibre ; bifurcations et fluctuations
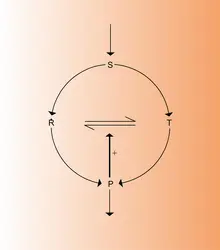
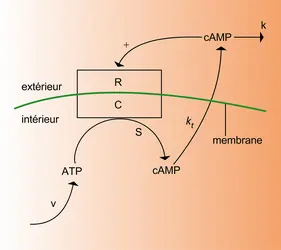
Dans un grand nombre de situations d'intérêt physique, il arrive que l'évolution d'un système soit régie par des lois non linéaires. Nous allons illustrer cette éventualité par un exemple chimique qui fait intervenir le phénomène de la catalyse. Considérons la décomposition de l'éther par pyrolyse en phase gazeuse. Dans des conditions usuelles, ce processus est relativement lent. L'addition de quelques pour cent d'iode, catalyseur, suffit pour faire croître le taux de décomposition de l'éther (soit la vitesse de réaction) de plusieurs centaines de fois, sans que l'iode soit consommée. On montre que la vitesse de ce processus catalysé suit alors la règle suivante :
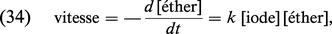
D'une manière générale, soit x1, ..., xn un ensemble de variables décrivant le comportement d'un système macroscopique (concentrations chimiques, température, vitesse d'écoulement, etc.). Moyennant des hypothèses très générales, ces variables obéissent à des équations d'évolution de la forme :
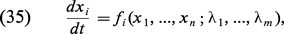
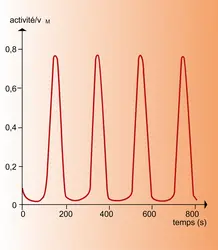
L'objet de notre analyse est d'étudier le comportement des systèmes décrits par des lois non linéaires de la forme (35). Comme la non-linéarité ouvre la voie à des solutions multiples, on doit s'attendre à des transitions entre états, ainsi qu'à la coexistence de régimes qualitativement différents. Grâce à ces phénomènes, les systèmes non linéaires ont la capacité de présenter un comportement complexe qui se traduit souvent par des morphologies inattendues et fort diversifiées ; c'est ainsi que la structure du flocon de neige ou celle de l'abdomen de la mouche drosophile, pour ne citer que deux exemples, sont des conséquences insoupçonnées d'une dynamique non linéaire sous-jacente.
Une première classification du comportement des systèmes non linéaires est fournie par la thermodynamique. L'objet de cette branche des sciences physiques est de dégager certaines propriétés caractérisant l'évolution des systèmes macroscopiques, qui soient largement indépendantes des détails des processus au niveau moléculaire. La plus importante de celles-ci est sans doute le second principe de la thermodynamique d'après lequel, dans un système isolé de son environnement, l'évolution conduit à un état où l'entropie, S, prend sa valeur maximale. C'est l'état d'équilibre thermodynamique. Un tel état est atteint également lorsque le système, au lieu d'être isolé, est maintenu à une température ou à une composition constantes (cf. thermodynamique - Lois fondamentales).
Revenons aux processus non linéaires. Un premier résultat établi par la thermodynamique est que, au voisinage de l'état d'équilibre, les non-linéarités ne peuvent jamais introduire un comportement nouveau (par rapport[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Agnès BABLOYANTZ : chef de travaux associé à l'Université libre de Bruxelles .
- Paul GLANSDORFF : professeur émérite de la faculté des sciences à l'université de Bruxelles, président d'honneur de l'Institut international du froid, membre de l'Académie royale
- Albert GOLDBETER : chef de travaux à l'université libre de Bruxelles
- Grégoire NICOLIS : professeur à l'Université libre de Bruxelles
- Ilya PRIGOGINE
: directeur des Instituts internationaux de physique et de chimie, fondés par Ernest Solvay à Bruxelles,
Ashbel Smith regental professor , université du Texas à Austin, directeur du Ilya Prigogine Center of Studies in Statistical Mechanics and Complex Systems, université du Texas à Austin
Classification
Médias
Autres références
-
THERMODYNAMIQUE (notions de base)
- Écrit par Bernard DIU
- 6 036 mots
De nos jours, on peut définir la thermodynamique comme la science des propriétés et des processus qui mettent en jeu la température et la chaleur.
Le nom de « thermodynamique » associe les deux mots grecs thermon (chaleur) et dynamis (puissance). Le but premier de la discipline, explicitement...
-
BOLTZMANN LUDWIG (1844-1906)
- Écrit par Pierre COSTABEL
- 1 636 mots
- 1 média
À partir de ce deuxième principe, Loschmidt a présenté à Boltzmann une objection redoutable, souvent reprise depuis lors, et qui consiste à affirmer l'impossibilité de faire sortir des équations réversibles de la mécanique une interprétation des processus irréversibles de la thermodynamique. Boltzmann... -
CARNOT SADI (1796-1832)
- Écrit par Robert FOX
- 841 mots
- 1 média
Fils aîné de Lazare Carnot, « l'Organisateur de la Victoire », Nicolas Léonard Sadi Carnot est un des pionniers de la thermodynamique. Son unique publication, les Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance, ignorée de son temps...
-
CHALEUR
- Écrit par Paul GLANSDORFF
- 985 mots
La première tentative d'interprétation physique assimilait la chaleur à un fluide dit subtil et indestructible dénommé le calorique, répandu partout au sein de la matière. Son passage d'un corps à un autre était notamment responsable du refroidissement du premier et de l'échauffement du second....
-
CLAUSIUS RUDOLF (1822-1888)
- Écrit par Robert FOX
- 1 001 mots
Rudolf Julius Emanuel Clausius, l'un des plus grands physiciens du xixe siècle, est connu principalement pour sa contribution à l'étude de la thermodynamique. Le premier, ce savant allemand formula ce qu'on a coutume d'appeler le deuxième principe et proposa une définition claire de l'...
- Afficher les 39 références