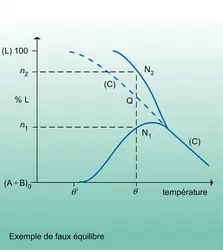
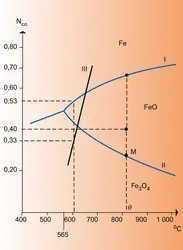
THERMODYNAMIQUE Thermodynamique chimique
Article modifié le
On peut dire qu'au milieu du xixe siècle les bases fondamentales de la thermodynamique classique et de la théorie de l'énergie étaient établies grâce aux travaux de V. Hess, S. Carnot, J. R. von Mayer, J. P. Joule, R. J. E. Clausius, lord Kelvin. Les lois ainsi mises au jour contribuèrent puissamment au développement des machines thermiques, mais leur rigueur et leur généralité incitèrent à les appliquer à toutes les modifications des corps qui nous entourent.
Les applications à la chimie prirent naissance avec les travaux de Clausius et d'Émile Clapeyron, mais c'est seulement dans le dernier quart du xixe siècle qu'elles se développèrent. La personnalité de J. W. Gibbs s'y détache et, grâce à son introduction systématique du potentiel chimique, l'évolution se poursuit de façon claire et logique.
Ces recherches, essentiellement théoriques, furent utilisées ultérieurement par des chercheurs de renom : H. W. B. Roozeboom (règle des phases), Van Laar, P. Duhem (applications du potentiel chimique). Enfin, G. N. Lewis simplifia le développement des calculs, en introduisant (1901) les notions de fugacité et d'activité, qui permettent, pour les gaz non parfaits et les solutions quelconques, d'exprimer le potentiel chimique des constituants de façon aussi simple que pour un gaz parfait.
Cependant, ces travaux se préoccupent peu de la réaction chimique elle-même ; les grandeurs envisagées se rapportent soit au système total, soit à l'un des constituants, mais non à la réaction (chaleur de réaction, travail maximal). Pourtant, l'intérêt de la thermodynamique pour le chimiste avait été pressenti dès 1866 par H. Sainte-Claire Deville, et aussi par Horstmann (1869), mais ce sont surtout H. L. Helmholtz, J. H. Van't Hoff et W. Nerst qui s'y attachèrent, et, au début du siècle, les chimistes généralisent son emploi. On retrouve à cette époque (1905), dans un remarquable travail de F. Haber, les données nécessaires au calcul des enthalpies libres de réactions.
Malgré les progrès indéniables qu'elle a introduits dans l'étude de la réaction chimique, la précédente conception n'envisage guère que les états d'équilibre et les transformations réversibles, alors qu'une réaction chimique est manifestement irréversible et qu'il est fondamental de prévoir si elle est possible. C'est pourquoi T. De Donder, depuis 1920, a introduit l'« affinité chimique », grandeur caractéristique de l'irréversibilité.
Ainsi, une thermodynamique chimique des états d'équilibre s'est substituée progressivement aux lois déjà connues de la thermochimie, mais avec une interprétation directement déduite des deux grands principes de la thermodynamique. D'où la dénomination actuelle.
Équilibres chimiques et prévision des réactions
Soit une réaction du type :

Dans le cas contraire, on dit qu'il y a équilibre : les produits d'arrivée et de départ coexistent alors, leurs proportions n'évoluant plus au cours du temps. Si A et B ne peuvent réagir complètement, c'est qu'au-delà d'un certain avancement de la réaction la recombinaison de L et de M s'y oppose. Un équilibre implique donc que, si A et B sont susceptibles de réagir de façon limitée, il en soit de même de L et de M, ce qu'on écrit :
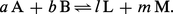
Il semble que ce soit Claude Berthollet qui ait considéré, dès 1803, que les réactions inverses que représente une équation chimique sont limitées l'une par l'autre, de[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre SOUCHAY : professeur à l'université de Paris-VI-Pierre-et-Marie Curie et à l'École nationale supérieure de chimie, Paris
Classification
Médias
Autres références
-
THERMODYNAMIQUE (notions de base)
- Écrit par Bernard DIU
- 6 036 mots
De nos jours, on peut définir la thermodynamique comme la science des propriétés et des processus qui mettent en jeu la température et la chaleur.
Le nom de « thermodynamique » associe les deux mots grecs thermon (chaleur) et dynamis (puissance). Le but premier de la discipline, explicitement...
-
BOLTZMANN LUDWIG (1844-1906)
- Écrit par Pierre COSTABEL
- 1 636 mots
- 1 média
À partir de ce deuxième principe, Loschmidt a présenté à Boltzmann une objection redoutable, souvent reprise depuis lors, et qui consiste à affirmer l'impossibilité de faire sortir des équations réversibles de la mécanique une interprétation des processus irréversibles de la thermodynamique. Boltzmann... -
CARNOT SADI (1796-1832)
- Écrit par Robert FOX
- 841 mots
- 1 média
Fils aîné de Lazare Carnot, « l'Organisateur de la Victoire », Nicolas Léonard Sadi Carnot est un des pionniers de la thermodynamique. Son unique publication, les Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance, ignorée de son temps...
-
CHALEUR
- Écrit par Paul GLANSDORFF
- 985 mots
La première tentative d'interprétation physique assimilait la chaleur à un fluide dit subtil et indestructible dénommé le calorique, répandu partout au sein de la matière. Son passage d'un corps à un autre était notamment responsable du refroidissement du premier et de l'échauffement du second....
-
CLAUSIUS RUDOLF (1822-1888)
- Écrit par Robert FOX
- 1 001 mots
Rudolf Julius Emanuel Clausius, l'un des plus grands physiciens du xixe siècle, est connu principalement pour sa contribution à l'étude de la thermodynamique. Le premier, ce savant allemand formula ce qu'on a coutume d'appeler le deuxième principe et proposa une définition claire de l'...
- Afficher les 39 références
Voir aussi
- OSTWALD LOI DE DILUTION D'
- PRESSION, physique
- VARIABLES INTENSIVES
- HAUT-FOURNEAU
- ÉQUILIBRE, chimie
- THERMODYNAMIQUE CHIMIQUE
- POTENTIEL CHIMIQUE
- VAN'T HOFF LOI DE
- PHASES RÈGLE DES ou RÈGLE DE GIBBS
- ENTHALPIE
- CONCENTRATION, chimie
- PILES & ACCUMULATEURS
- VARIANCE, thermodynamique
- TEMPÉRATURE
- MÉTASTABILITÉ, chimie physique
- GIBBS-HELMHOLTZ FORMULES DE
- LE CHATELIER PRINCIPE DE
- KIRCHHOFF ÉQUATION DE
- THOMSEN JULIUS (1826-1909)
- ENTHALPIE LIBRE ou ÉNERGIE LIBRE DE GIBBS
- BERTHELOT PRINCIPE DE
- ACTION DE MASSE LOI D' ou LOI DE GULDBERG & WAAGE
- CHALEUR DE RÉACTION
- ADIABATIQUE TRANSFORMATION
- CHIMIE HISTOIRE DE LA
- CONSTITUANT, chimie
- TRANSFORMATIONS THERMODYNAMIQUES
- TRANSFORMATION RÉVERSIBLE
- PRESSION PARTIELLE