THERMODYNAMIQUE Thermodynamique chimique
Potentiel chimique
Après Gibbs, l'emploi du potentiel chimique molaire :
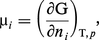
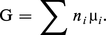
Pour une transformation où l'on fait varier arbitrairement le nombre de moles à température et à pression constantes, on a :
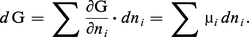
Puisque l'on a posé au chapitre 3 de l'article thermodynamique - B. Lois fondamentales :
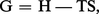
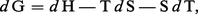
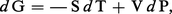
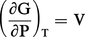
Compte tenu de la relation PV = nRT, si le gaz est parfait, on peut tirer :
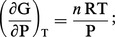
Si le gaz i appartient à un mélange de gaz parfaits dans lequel les interactions sont négligeables, on peut considérer que ses propriétés sont indépendantes des autres constituants, et l'on appelle pression partielle pi celle qu'il aurait s'il occupait à lui seul tout le volume pi = niRT/V à la même température.
Par analogie, on aura ainsi :
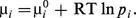
On peut remarquer que, si l'on désigne par concentration ci le nombre de moles par unité de volume, on obtient pi = ciRT, soit, en introduisant dans μ0 tout ce qui dépend de T,
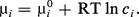
Si l'espèce i et celles qui l'accompagnent (solutés) sont dissoutes en concentrations suffisamment faibles dans un solvant, il n'y a d'interactions qu'avec les molécules de ce dernier. On considère que l'espèce i se comporte dans le solvant comme le ferait un gaz parfait (dans le vide) à la même concentration et on applique l'équation précédente.
Cependant, lorsque ci ou les concentrations des autres solutés croissent, le comportement se complique et μi devient de la forme :
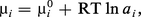
L'état standard d'un composé est l'état de ce composé pur à la température considérée, sous la pression de 1 atmosphère. S'il est en solution, son activité doit être égale à 1 (ou sa concentration si, pour 1 mole/litre, il obéit encore aux lois des solutions diluées).
Dans les formules précédentes, les μ0 représentent donc des potentiels chimiques standards.
Équilibre entre plusieurs phases
On appelle variance d'un système hétérogène (à plusieurs phases) le nombre minimal de variables intensives nécessaires pour fixer son état, c'est-à-dire les valeurs des autres variables.
Les constituants d'un système chimique ne sont pas indépendants, car l'un d'entre eux peut prendre naissance à partir des autres, par suite de la réaction chimique ; on appelle constituants indépendants le nombre de constituants, diminué du nombre de réactions en équilibre possibles. Ainsi dans la réaction CaCO3 ⇌ CaO + CO2 il n'y a que deux constituants indépendants.
La règle des phases, ou règle de Gibbs, sert à fixer la variance. Soit n le nombre des constituants indépendants et ϕ le nombre de phases. La composition de chaque phase serait définie si l'on connaissait les proportions des constituants, soit (n − 1) quantités inconnues (la dernière se déduit des autres, puisque la somme des proportions est égale à 1) ; au total, il faut connaître ϕ(n − 1)[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre SOUCHAY : professeur à l'université de Paris-VI-Pierre-et-Marie Curie et à l'École nationale supérieure de chimie, Paris
Classification
Médias
Autres références
-
THERMODYNAMIQUE (notions de base)
- Écrit par Bernard DIU
- 6 036 mots
De nos jours, on peut définir la thermodynamique comme la science des propriétés et des processus qui mettent en jeu la température et la chaleur.
Le nom de « thermodynamique » associe les deux mots grecs thermon (chaleur) et dynamis (puissance). Le but premier de la discipline, explicitement...
-
BOLTZMANN LUDWIG (1844-1906)
- Écrit par Pierre COSTABEL
- 1 634 mots
- 1 média
À partir de ce deuxième principe, Loschmidt a présenté à Boltzmann une objection redoutable, souvent reprise depuis lors, et qui consiste à affirmer l'impossibilité de faire sortir des équations réversibles de la mécanique une interprétation des processus irréversibles de la thermodynamique. Boltzmann... -
CARNOT SADI (1796-1832)
- Écrit par Robert FOX
- 841 mots
- 1 média
Fils aîné de Lazare Carnot, « l'Organisateur de la Victoire », Nicolas Léonard Sadi Carnot est un des pionniers de la thermodynamique. Son unique publication, les Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance, ignorée de son temps...
-
CHALEUR
- Écrit par Paul GLANSDORFF
- 985 mots
La première tentative d'interprétation physique assimilait la chaleur à un fluide dit subtil et indestructible dénommé le calorique, répandu partout au sein de la matière. Son passage d'un corps à un autre était notamment responsable du refroidissement du premier et de l'échauffement du second....
-
CLAUSIUS RUDOLF (1822-1888)
- Écrit par Robert FOX
- 1 001 mots
Rudolf Julius Emanuel Clausius, l'un des plus grands physiciens du xixe siècle, est connu principalement pour sa contribution à l'étude de la thermodynamique. Le premier, ce savant allemand formula ce qu'on a coutume d'appeler le deuxième principe et proposa une définition claire de l'...
- Afficher les 39 références