THERMODYNAMIQUE Thermodynamique chimique
Grandeurs caractéristiques d'une réaction
Chaleur de réaction
Soit une réaction du type :
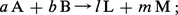
On voit (Th. 3), en faisant dP = 0, qu'une intégration immédiate entre états final et initial donne :

Comme H est une fonction d'état, ΔH (donc Q) ne dépend que des états initial et final parmi l'ensemble des transformations isobares. De même (Th. 2), pour les isomètres (dV = 0), Q devient une fonction d'état : Q = ΔE (lois de Hess).
La variation d'enthalpie ΔH est évaluée (en particulier par calorimétrie) à la température ordinaire. Si la réaction est étudiée à température élevée, il est nécessaire de connaître ΔH en fonction de T.
Pour cela, appliquons la relation (Th. 3) :
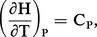
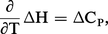
Si Ci désigne la capacité thermique molaire de chaque constituant, on a :
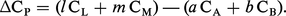
L'intégration de cette équation entre la température ordinaire (généralement 25 0C, soit 298 K) et la température envisagée permet de connaître ΔH pour cette dernière si les Ci sont connus en fonction de T :
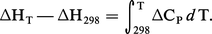
Enthalpie libre de réaction
L' enthalpie libre de réaction est la variation d'enthalpie libre ΔG accompagnant une réaction aA + bB → lL + mM, effectuée dans les conditions où se trouve le système, en ce qui concerne la température, la pression totale et les proportions des réactifs.
Il faut donc calculer la variation ΔGT,P lorsque, à une température T et à une pression P données, A et B réagissent selon leurs coefficients de réaction pour donner L et M ; on supposera le système en forte quantité, afin que la transformation ne perturbe pas sa composition.
La formule dG = Σμi dni donne, avec ΔnA = − a, ΔnB = − b, ΔnL = l et ΔnM = m, la relation suivante :
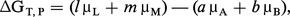
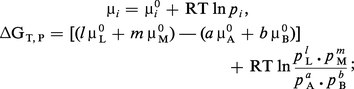
Si la réaction a lieu en solution, on obtient une expression analogue en substituant les ai (ou les ci) aux pi.
Entropie de réaction
On appelle entropie de réaction la variation ΔS d'entropie accompagnant une réaction, soit :

Cette grandeur est liée à la chaleur de réaction et à l'enthalpie libre de réaction, car de l'expression G = H − TS on déduit pour une température T donnée :
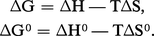
Les entropies des substances, de même que ΔH, étant accessibles par mesures de CP (Th. 12), donc par calorimétrie, on dispose ainsi d'un moyen de détermination de ΔG par calorimétrie uniquement.
Enthalpies et enthalpies libres standards de formation
On appelle enthalpie de formation d'un composé sa chaleur de formation à pression constante à partir de ses éléments ; ainsi, pour la réaction :
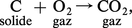
On a dressé des tables d'enthalpies standards de formation (généralement à 25 0C), car leur connaissance permet de calculer la variation d'enthalpie de toute réaction.
L'enthalpie H étant une fonction d'état, sa variation ΔH ne dépend que des états initial et final. On peut donc décomposer la réaction en deux étapes : dans la première, on dissocie les produits réagissants en leurs éléments, ce qui libère leurs enthalpies de formation changées de signe ; dans la seconde[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre SOUCHAY : professeur à l'université de Paris-VI-Pierre-et-Marie Curie et à l'École nationale supérieure de chimie, Paris
Classification
Médias
Autres références
-
THERMODYNAMIQUE (notions de base)
- Écrit par Bernard DIU
- 6 036 mots
De nos jours, on peut définir la thermodynamique comme la science des propriétés et des processus qui mettent en jeu la température et la chaleur.
Le nom de « thermodynamique » associe les deux mots grecs thermon (chaleur) et dynamis (puissance). Le but premier de la discipline, explicitement...
-
BOLTZMANN LUDWIG (1844-1906)
- Écrit par Pierre COSTABEL
- 1 634 mots
- 1 média
À partir de ce deuxième principe, Loschmidt a présenté à Boltzmann une objection redoutable, souvent reprise depuis lors, et qui consiste à affirmer l'impossibilité de faire sortir des équations réversibles de la mécanique une interprétation des processus irréversibles de la thermodynamique. Boltzmann... -
CARNOT SADI (1796-1832)
- Écrit par Robert FOX
- 841 mots
- 1 média
Fils aîné de Lazare Carnot, « l'Organisateur de la Victoire », Nicolas Léonard Sadi Carnot est un des pionniers de la thermodynamique. Son unique publication, les Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance, ignorée de son temps...
-
CHALEUR
- Écrit par Paul GLANSDORFF
- 985 mots
La première tentative d'interprétation physique assimilait la chaleur à un fluide dit subtil et indestructible dénommé le calorique, répandu partout au sein de la matière. Son passage d'un corps à un autre était notamment responsable du refroidissement du premier et de l'échauffement du second....
-
CLAUSIUS RUDOLF (1822-1888)
- Écrit par Robert FOX
- 1 001 mots
Rudolf Julius Emanuel Clausius, l'un des plus grands physiciens du xixe siècle, est connu principalement pour sa contribution à l'étude de la thermodynamique. Le premier, ce savant allemand formula ce qu'on a coutume d'appeler le deuxième principe et proposa une définition claire de l'...
- Afficher les 39 références