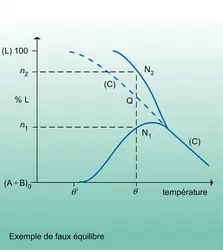
THERMODYNAMIQUE Thermodynamique chimique
Article modifié le
Les équilibres chimiques
La connaissance de la variation d'enthalpie libre ΔG est fondamentale, car, à T et à P données, si, dans les conditions de l'expérience, cette variation est négative, les composants du système réagiront (cf. thermodynamique - Lois fondamentales). En revanche, si en fonction des conditions opératoires, la valeur de G est minimale, elle ne pourra diminuer : le système n'évoluera pas, et il sera donc en équilibre ; la condition d'équilibre s'écrira, par suite, en exprimant ΔGT,P pour une transformation possible et en écrivant ΔGT,P = 0.
Conditions d'équilibre
La condition précédente appliquée à la variation ΔGT,P de réaction donne, en posant ΔG0 = − RT ln KP,
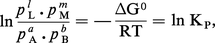
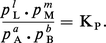
Dans le cas des gaz parfaits, la « constante » d'action de masse KP ne dépend que de la température, comme ΔG0, et lui est liée directement, ce qui lui donne sa signification physique.
En solution, une relation du même ordre est applicable aux activités ou aux concentrations ai ou ci, KP étant remplacée par Ka, constante d'action de masse appliquée aux activités.
Il est souvent plus souhaitable d'obtenir une relation entre les proportions des constituants. La loi des gaz parfaits s'applique aussi bien à chaque constituant i qu'à l'ensemble :

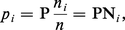
En transposant dans la relation précédente, on obtient, en posant Δν = (l + m) − (a + b),
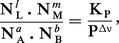
Cas des systèmes hétérogènes
Il arrive fréquemment que, dans un système hétérogène, un constituant ou plusieurs forment une phase solide pure ; un tel constituant est alors dans son état standard, et l'on a μi = μi0 ; il s'ensuit qu'il n'intervient pas dans l'expression du premier membre donnant les pi ou les Ni, ainsi que dans l'évaluation de Δν.
Soit les trois exemples suivants de systèmes hétérogènes.
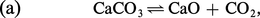
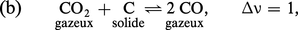
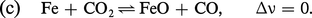
On obtient de même :
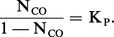
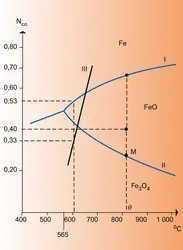
Le système est bivariant, avec n = 3 et ϕ = 3 ; cependant, l'expression précédente montre que NCO ne dépend que de T (par l'intermédiaire de KP), ce qui pourrait faire croire qu'il est monovariant.
En réalité, pour qu'il en soit ainsi, il faudrait que toutes ses propriétés ne dépendent que de T ; or, s'il en est ainsi pour NCO, ce n'est pas le cas, par exemple pour pCO = NCO/P qui dépend également de P.
Le système 3FeO + CO2 ⇌ Fe3O4 + CO se traite de même (cf. chap. 6).
Variations de KP avec T
La formule de Gibbs-Helmholtz (cf. thermodynamique - Lois fondamentales, équation 20) s'applique aussi bien, à température constante, à l'état final qu'à l'état initial ; en raisonnant sur les grandeurs standards, on obtient alors :
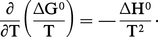
Pour une réaction chimique, on a montré que :
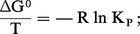
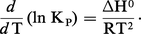
L'équation ci-dessus est également valable pour Ka.
Cette relation, dite équation de Van't Hoff, est extrêmement importante, puisqu'elle permet, à partir de la seule connaissance de la chaleur de réaction, de connaître, par intégration, KP à toute température T, à condition de la connaître à une température donnée θ :

L'opération précédente suppose ΔH0 constante ; si, au contraire, elle varie avec T, on l'exprimera en fonction de T en utilisant la formule de Kirchhoff. En reportant sa valeur dans l'équation de Van't Hoff, l'intégration de cette dernière entre T et θ permettra de même d'exprimer KP en fonction de T.
Déplacement de l'équilibre
Les proportions Ni des constituants, dans un équilibre, dépendent généralement de la température, de la pression et des proportions utilisées au départ qui ne correspondent pas obligatoirement aux coefficients de réaction. Si l'on modifie l'un de ces facteurs, l'équilibre se modifie également (on dit qu'il se déplace). Pour savoir dans quel sens il le fait, on pourra toujours calculer les nouvelles valeurs des Ni, en utilisant en particulier la formule :

Influence de la température
Les variables autres que la température étant maintenues constantes, l'équation de Van't Hoff donne (voir ci-dessus) :

Si la variation d'enthalpie (ΔH) est positive (réaction endothermique), on voit que ln KN et, par suite, KN croissent par élévation de température, ce qui ne peut se faire que si NL, NM augmentent et si NA, NB diminuent : ainsi, une élévation de température déplace l'équilibre dans le sens endothermique.
Influence de la pression et du volume
Les variables autres que la pression étant maintenues constantes, on peut écrire :

Un raisonnement analogue au précédent montre que − Δν joue dans cette discussion le même rôle que ΔH : un accroissement de la pression, déplace l'équilibre dans le sens de la diminution du nombre de molécules.
Ainsi, dans la synthèse de l'ammoniac :

En ce qui concerne l'influence du volume, étant donné que le volume d'un système gazeux varie en sens inverse de sa pression, l'influence d'un accroissement de volume (à pression constante) sera la même que celle d'une diminution de pression (à volume constant), les autres variables étant maintenues constantes.
Ces considérations sont valables pour une solution où l'accroissement de volume est réalisé par addition d'un solvant supposé chimiquement inerte vis-à-vis des espèces dissoutes étudiées. Par exemple, la dissociation d'un électrolyte AB en ses ions, qui donne lieu à un équilibre si l'électrolyte est faible :

Appelons c la concentration globale de l'électrolyte, dissocié ou non, Ka la constante d'action de masse et α la fraction dissociée comprise entre 0 et 1 ; les concentrations de A- et de B+ sont chacune égales à αc, et celle de AB non dissocié est pratiquement égale à c si l'on admet que α est faible. La loi d'action de masse appliquée aux concentrations donne la loi de dilution d' Ostwald :

Les constatations précédentes peuvent se résumer dans une proposition qualitative très générale connue sous le nom de principe de Le Chatelier : Toute modification de l'un des facteurs de l'équilibre déplace cet équilibre dans un sens qui tend à s'opposer à la variation du facteur considéré. Ainsi :
– Lorsqu'on accroît la température (en fournissant de la chaleur), le système réagit en sens inverse (endothermique) ;
– Lorsqu'on accroît la pression, il tend à s'opposer à cette augmentation, en diminuant le nombre n des molécules (puisque, s'il est gazeux, P = nRT/V) ;
– Lorsqu'on accroît le volume (solution), on diminue la concentration des espèces en solution, et le système réagira dans le sens de leur accroissement...
Influence des proportions au départ
Les mêmes considérations laissent penser qu'en augmentant la proportion d'un des réactifs de départ, B par exemple, le système réagira dans le sens de la consommation de celui-ci (sens →), comme le montre la formule utilisée : si NB croît, il doit en être de même de NL et de NM pour que la constance de KN soit respectée.
Une complication apparaît néanmoins pour les systèmes gazeux évoluant à pression constante : l'introduction de B produit en effet un accroissement de V (puisque P est maintenue constante). Le déplacement d'équilibre sera dû non seulement à l'excès de B (sens →), mais également à l'accroissement de V. Les deux facteurs sont concordants avec Δν > 0, mais se contrarient si Δν < 0.
On peut montrer que, si Δν ≤ − b, la proportion de A consommée croît avec le rapport moles B/moles A au départ (exemple N2 + 3 H2 → 2 NH3, où B = H2 et b = 3) ; sinon (exemple 3 H2 + N2 → 2 NH3, où B = N2, b = 1), elle passe par un maximum pour une certaine valeur de ce rapport, égal à − b/(Δν + b), (soit 1 dans le dernier exemple, alors que 1/3 correspond au rapport stœchiométrique) et s'annule aux rapports élevés.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre SOUCHAY : professeur à l'université de Paris-VI-Pierre-et-Marie Curie et à l'École nationale supérieure de chimie, Paris
Classification
Médias
Autres références
-
THERMODYNAMIQUE (notions de base)
- Écrit par Bernard DIU
- 6 036 mots
De nos jours, on peut définir la thermodynamique comme la science des propriétés et des processus qui mettent en jeu la température et la chaleur.
Le nom de « thermodynamique » associe les deux mots grecs thermon (chaleur) et dynamis (puissance). Le but premier de la discipline, explicitement...
-
BOLTZMANN LUDWIG (1844-1906)
- Écrit par Pierre COSTABEL
- 1 636 mots
- 1 média
À partir de ce deuxième principe, Loschmidt a présenté à Boltzmann une objection redoutable, souvent reprise depuis lors, et qui consiste à affirmer l'impossibilité de faire sortir des équations réversibles de la mécanique une interprétation des processus irréversibles de la thermodynamique. Boltzmann... -
CARNOT SADI (1796-1832)
- Écrit par Robert FOX
- 841 mots
- 1 média
Fils aîné de Lazare Carnot, « l'Organisateur de la Victoire », Nicolas Léonard Sadi Carnot est un des pionniers de la thermodynamique. Son unique publication, les Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance, ignorée de son temps...
-
CHALEUR
- Écrit par Paul GLANSDORFF
- 985 mots
La première tentative d'interprétation physique assimilait la chaleur à un fluide dit subtil et indestructible dénommé le calorique, répandu partout au sein de la matière. Son passage d'un corps à un autre était notamment responsable du refroidissement du premier et de l'échauffement du second....
-
CLAUSIUS RUDOLF (1822-1888)
- Écrit par Robert FOX
- 1 001 mots
Rudolf Julius Emanuel Clausius, l'un des plus grands physiciens du xixe siècle, est connu principalement pour sa contribution à l'étude de la thermodynamique. Le premier, ce savant allemand formula ce qu'on a coutume d'appeler le deuxième principe et proposa une définition claire de l'...
- Afficher les 39 références
Voir aussi
- OSTWALD LOI DE DILUTION D'
- PRESSION, physique
- VARIABLES INTENSIVES
- HAUT-FOURNEAU
- ÉQUILIBRE, chimie
- THERMODYNAMIQUE CHIMIQUE
- POTENTIEL CHIMIQUE
- VAN'T HOFF LOI DE
- PHASES RÈGLE DES ou RÈGLE DE GIBBS
- ENTHALPIE
- CONCENTRATION, chimie
- PILES & ACCUMULATEURS
- VARIANCE, thermodynamique
- TEMPÉRATURE
- MÉTASTABILITÉ, chimie physique
- GIBBS-HELMHOLTZ FORMULES DE
- LE CHATELIER PRINCIPE DE
- KIRCHHOFF ÉQUATION DE
- THOMSEN JULIUS (1826-1909)
- ENTHALPIE LIBRE ou ÉNERGIE LIBRE DE GIBBS
- BERTHELOT PRINCIPE DE
- ACTION DE MASSE LOI D' ou LOI DE GULDBERG & WAAGE
- CHALEUR DE RÉACTION
- ADIABATIQUE TRANSFORMATION
- CHIMIE HISTOIRE DE LA
- CONSTITUANT, chimie
- TRANSFORMATIONS THERMODYNAMIQUES
- TRANSFORMATION RÉVERSIBLE
- PRESSION PARTIELLE