THERMODYNAMIQUE Thermodynamique chimique
Prévisions des transformations
Transformations adiabatiques
Si une transformation chimique a lieu, elle obéit à l'inégalité de Clausius représentant l'évolution spontanée du système, soit :

Si, de plus, elle est adiabatique, à tout moment dQ = 0, donc la condition pour que la transformation ait lieu est ΔS > 0.
On a vu que la condition pour qu'une réaction à température et à pression données ait lieu est que la variation d'énergie libre qui l'accompagne soit négative. Utilisant l'expression de ΔGT,P donnée plus haut et compte tenu de GT,P = − RT ln KP, on déduit la condition :
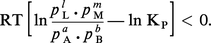
Il faut bien remarquer que les pi désignent maintenant les valeurs actuelles dans le système et non les valeurs à l'équilibre ; si ΔG est très négatif, le système est très éloigné de l'équilibre et la transformation sera d'autant plus aisée.
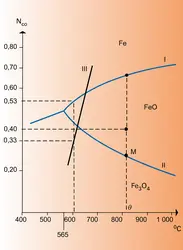
Afin de réaliser, par exemple, la réaction :
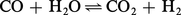
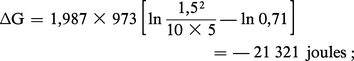
Si ΔG est positif, c'est évidemment la réaction inverse qui a lieu.
Dans une transformation à la température T, il arrive fréquemment que le terme entropique TΔS de l'expression ΔG = ΔH − TΔS soit petit par rapport au terme enthalpique (chaleur de réaction), surtout si T est faible ; dans ce cas, les conditions ΔG < 0 et ΔH < 0 sont équivalentes. On retrouve le principe de Berthelot : Si plusieurs réactions sont possibles, la plus exothermique est la plus probable.
La condition ΔG < 0 est évidemment la seule rigoureuse.
Elle est d'ailleurs directement connectée à la notion d'affinité et à celle de variable chimique. Lorsqu'on utilise le potentiel chimique molaire (cf. 2, potentiel chimique), ces relations prennent la forme :
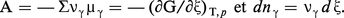
Une intégration entre ξ = 0 et ξ = 1, ce qui correspond à un équivalent de la réaction, donne la relation cherchée :
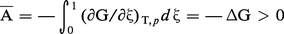
Valeur de ces prévisions
Si l'on calcule à température ordinaire la variation d'énergie libre de la réaction :
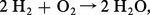
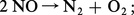
De toute façon, la connaissance de ΔG est très utile, car un ΔG positif prouve que la réaction est impossible, et cette connaissance évite bien des essais inutiles.
On peut constater ainsi que l'étude de la cinétique complète celle de la thermodynamique.
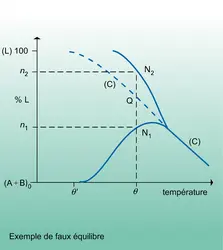
Revenons au système H2 + O2 gazeux à la température ordinaire ; on peut considérer qu'il est bien en équilibre, puisque le temps ne le modifie pas, cependant il ne constitue pas l'état le plus stable de ce système : on dit qu'il est métastable.
La métastabilité peut toujours être[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre SOUCHAY : professeur à l'université de Paris-VI-Pierre-et-Marie Curie et à l'École nationale supérieure de chimie, Paris
Classification
Médias
Autres références
-
THERMODYNAMIQUE (notions de base)
- Écrit par Bernard DIU
- 6 036 mots
De nos jours, on peut définir la thermodynamique comme la science des propriétés et des processus qui mettent en jeu la température et la chaleur.
Le nom de « thermodynamique » associe les deux mots grecs thermon (chaleur) et dynamis (puissance). Le but premier de la discipline, explicitement...
-
BOLTZMANN LUDWIG (1844-1906)
- Écrit par Pierre COSTABEL
- 1 634 mots
- 1 média
À partir de ce deuxième principe, Loschmidt a présenté à Boltzmann une objection redoutable, souvent reprise depuis lors, et qui consiste à affirmer l'impossibilité de faire sortir des équations réversibles de la mécanique une interprétation des processus irréversibles de la thermodynamique. Boltzmann... -
CARNOT SADI (1796-1832)
- Écrit par Robert FOX
- 841 mots
- 1 média
Fils aîné de Lazare Carnot, « l'Organisateur de la Victoire », Nicolas Léonard Sadi Carnot est un des pionniers de la thermodynamique. Son unique publication, les Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance, ignorée de son temps...
-
CHALEUR
- Écrit par Paul GLANSDORFF
- 985 mots
La première tentative d'interprétation physique assimilait la chaleur à un fluide dit subtil et indestructible dénommé le calorique, répandu partout au sein de la matière. Son passage d'un corps à un autre était notamment responsable du refroidissement du premier et de l'échauffement du second....
-
CLAUSIUS RUDOLF (1822-1888)
- Écrit par Robert FOX
- 1 001 mots
Rudolf Julius Emanuel Clausius, l'un des plus grands physiciens du xixe siècle, est connu principalement pour sa contribution à l'étude de la thermodynamique. Le premier, ce savant allemand formula ce qu'on a coutume d'appeler le deuxième principe et proposa une définition claire de l'...
- Afficher les 39 références