THERMODYNAMIQUE Thermodynamique chimique
Exemple d'application
Choisissons l'exemple des deux équilibres suivants :
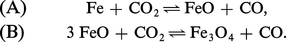
Étude des équilibres
Pour les deux équilibres, on a :
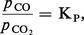
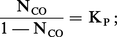
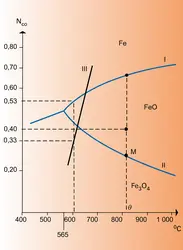
L'allure de la courbe I montre que l'élévation de la température favorise la réaction dans le sens → (NCO croît) : la réaction est donc endothermique ; c'est l'inverse qui se produit pour la courbe II.
Pour ce système, qui implique les mêmes constituants, il est possible d'obtenir deux équilibres où l'on observe successivement l'oxydation, par CO2, de Fe en FeO (cas de la courbe I), puis celle de FeO en Fe3O4 (courbe II), d'où le nom d'équilibres successifs donné à ceux-ci.
Les points situés sur les courbes I et II correspondent à des ensembles vérifiant les équilibres (A) ou (B), impliquant deux phases solides (Fe-FeO ou FeO-Fe3O4). Au contraire, les points situés en dehors de ces courbes ne satisfont plus à ces conditions et sont relatifs à l'existence d'une seule phase. Celle-ci doit être d'autant moins oxydée que le mélange gazeux correspondant à l'un de ces points est plus riche en gaz réducteur (NCO plus élevé) ; donc, à une température telle que θ, on doit rencontrer successivement, vers les NCO croissants, les domaines de Fe3O4, de FeO et de Fe.
Par exemple, la phase solide rencontrée à la température θ et pour un mélange gazeux de fraction molaire 0,40 en CO sera du FeO.
De plus, on constate que, lorsque la température décroît, le domaine d'existence de FeO s'amenuise pour disparaître vers 565 0C ; au-dessous de cette température, on assiste à l'équilibre Fe-Fe3O4 :
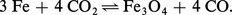
Si FeO peut exister à la température ordinaire, c'est parce qu'il se trouve à l'état métastable (obtenu par trempe) ; la variation d'énergie libre de la réaction :
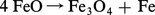
La figure montre qu'à la température θ Fe3O4 et FeO seront en équilibre pour une proportion NCO correspondant à l'ordonnée du point M. Si NCO prend une valeur soit un peu supérieure, soit un peu inférieure à celle-ci, il y aura transformation, respectivement, en FeO ou en Fe3O4.
C'est là un critère de la réversibilité : une modification même faible des conditions opératoires provoque un déplacement sensible de l'équilibre, et des modifications de sens contraire conduisent à des effets inverses.
Réduction des oxydes de fer dans un haut fourneau
Dans un haut fourneau, il y a toujours un excès de carbone (coke), et l'équilibre CO2 + C = 2 CO (, courbe III, à la pression atmosphérique) doit obligatoirement être réalisé ; NCO, imposé en principe (cf. supra), devrait décroître lorsque la température diminue (réaction endothermique).
À la partie inférieure, il y a combustion du carbone par injection d'air chaud, et la température est telle (supérieure à 1 000 0C) que NCO est très voisin de 1.
Les gaz, en s'élevant, traversent des couches de minerai et de coke de moins en moins chaudes ; si le système précédent était constamment en équilibre à ces diverses températures, NCO devrait diminuer à mesure qu'on s'élève : par exemple, à 600 0C et pour une pression de 1 atm., il serait de 1/3. La figure montre qu'on se trouverait alors dans le domaine d'existence de Fe3O4, et la réduction en fer métallique ne serait pas possible. Un calcul de la variation d'énergie libre ΔG, fait dans des conditions comparables au calcul donné au chapitre 5, montrerait qu'effectivement cette quantité est positive. En réalité l'équilibre réalisé au bas du fourneau (NCO ∼ 1) ne se déplace que très lentement par rapport au temps nécessaire aux gaz pour s'élever à travers les différentes[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre SOUCHAY : professeur à l'université de Paris-VI-Pierre-et-Marie Curie et à l'École nationale supérieure de chimie, Paris
Classification
Médias
Autres références
-
THERMODYNAMIQUE (notions de base)
- Écrit par Bernard DIU
- 6 036 mots
De nos jours, on peut définir la thermodynamique comme la science des propriétés et des processus qui mettent en jeu la température et la chaleur.
Le nom de « thermodynamique » associe les deux mots grecs thermon (chaleur) et dynamis (puissance). Le but premier de la discipline, explicitement...
-
BOLTZMANN LUDWIG (1844-1906)
- Écrit par Pierre COSTABEL
- 1 634 mots
- 1 média
À partir de ce deuxième principe, Loschmidt a présenté à Boltzmann une objection redoutable, souvent reprise depuis lors, et qui consiste à affirmer l'impossibilité de faire sortir des équations réversibles de la mécanique une interprétation des processus irréversibles de la thermodynamique. Boltzmann... -
CARNOT SADI (1796-1832)
- Écrit par Robert FOX
- 841 mots
- 1 média
Fils aîné de Lazare Carnot, « l'Organisateur de la Victoire », Nicolas Léonard Sadi Carnot est un des pionniers de la thermodynamique. Son unique publication, les Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance, ignorée de son temps...
-
CHALEUR
- Écrit par Paul GLANSDORFF
- 985 mots
La première tentative d'interprétation physique assimilait la chaleur à un fluide dit subtil et indestructible dénommé le calorique, répandu partout au sein de la matière. Son passage d'un corps à un autre était notamment responsable du refroidissement du premier et de l'échauffement du second....
-
CLAUSIUS RUDOLF (1822-1888)
- Écrit par Robert FOX
- 1 001 mots
Rudolf Julius Emanuel Clausius, l'un des plus grands physiciens du xixe siècle, est connu principalement pour sa contribution à l'étude de la thermodynamique. Le premier, ce savant allemand formula ce qu'on a coutume d'appeler le deuxième principe et proposa une définition claire de l'...
- Afficher les 39 références