THERMODYNAMIQUE Thermodynamique chimique
Relations entre grandeurs chimiques et grandeurs électrochimiques
Les piles chimiques
Lorsqu'on plonge un métal (du zinc par exemple) dans une solution d'un de ses sels (ions Zn2+), il s'établit une différence de potentiel entre le métal et la solution, qu'on explique par un équilibre métal-ions avec les électrons libres du métal du type :

Pour le cuivre, on aurait de même :
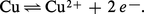
Dans les conditions ordinaires, l'émission d'ions par le métal est très faible, en raison du champ antagoniste intense qui s'établit aussitôt, et s'oppose à leur détachement ultérieur, si bien que le métal reste pratiquement inaltéré. Cependant, si l'on réunit les deux métaux par un fil conducteur et si l'on réalise la jonction des solutions dans lesquelles ils plongent en séparant celles-ci par une paroi poreuse, afin d'éviter leur mélange, les électrons s'écouleront du métal le plus facilement ionisable (le plus électropositif), en l'occurrence le zinc, vers l'autre. On assistera ainsi à un déplacement d'équilibre continuel dans le sens → pour le premier métal, ou dans le sens ← pour le second, ce qui se traduira par la réaction :

L'ensemble réalisé constitue une pile (pile Daniell) ; la différence de potentiel entre les deux métaux (électrodes) s'appelle force électromotrice (f.é.m.)E ; la réaction qui s'effectue a pour conséquence la production de courant, en raison du déplacement des électrons. Il y a évidemment une relation immédiate entre intensité débitée et vitesse de réaction.
Notion de réversibilité
Si l'on applique aux bornes de la pile précédente une force électromotrice égale et opposée à E, on n'observe ni courant ni réaction ; le système est donc en équilibre. En revanche, si l'on applique une force électromotrice, égale à E ± ε, légèrement différente, on observe, selon le signe de ε, un courant sensible dans l'un ou l'autre sens, accompagné d'un déplacement de la réaction dans le sens primitif ou dans le sens inverse (dissolution de cuivre et dépôt zinc). Dans le premier sens, le système continue à fonctionner comme pile ; dans le second, où la force électromotrice antagoniste est suffisante pour inverser le sens de circulation des électrons, il fonctionne comme cellule d'électrolyse. Un tel comportement est entièrement conforme aux critères de réversibilité donnés pour une réaction chimique (cf. chap. 6).
Il existe en revanche des systèmes où ε doit acquérir, dans l'un ou l'autre sens, une valeur notable pour observer un effet mesurable sur la valeur de l'intensité, donc sur le cours de la réaction (surtension) : ces systèmes sont irréversibles.
Les courbes de polarisation (cf. électrochimie, fig. 3) traduisent bien ces considérations.
Grandeurs chimiques et électrochimiques
La réaction chimique qui a lieu dans la pile Daniell pourrait tout aussi bien s'effectuer par des moyens chimiques : une lame de zinc trempée dans une solution de sel de cuivre se recouvre de cuivre métallique. Cependant, dans ce dernier cas, la transformation est notoirement irréversible, car son sens (dépôt de zinc) ne peut être changé en modifiant quelque peu les conditions opératoires, alors qu'on y parvient par voie électrochimique. Néanmoins, la variation d'énergie libre est la même dans les deux cas, puisqu'il s'agit des mêmes états initial et final ; il doit donc exister des relations entre grandeurs chimiques et électrochimiques.
Les définitions de l'enthalpie libre (G = H − TS) et de l'enthalpie (H = E + PV) conduisent à G = E + PV − TS, soit, pour une transformation à température et à pression constantes,
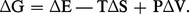
Si, de plus, la transformation est réversible, on peut écrire TΔS = Qr (Th. 7) et, puisque ΔE = Qr − W[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre SOUCHAY : professeur à l'université de Paris-VI-Pierre-et-Marie Curie et à l'École nationale supérieure de chimie, Paris
Classification
Médias
Autres références
-
THERMODYNAMIQUE (notions de base)
- Écrit par Bernard DIU
- 6 036 mots
De nos jours, on peut définir la thermodynamique comme la science des propriétés et des processus qui mettent en jeu la température et la chaleur.
Le nom de « thermodynamique » associe les deux mots grecs thermon (chaleur) et dynamis (puissance). Le but premier de la discipline, explicitement...
-
BOLTZMANN LUDWIG (1844-1906)
- Écrit par Pierre COSTABEL
- 1 634 mots
- 1 média
À partir de ce deuxième principe, Loschmidt a présenté à Boltzmann une objection redoutable, souvent reprise depuis lors, et qui consiste à affirmer l'impossibilité de faire sortir des équations réversibles de la mécanique une interprétation des processus irréversibles de la thermodynamique. Boltzmann... -
CARNOT SADI (1796-1832)
- Écrit par Robert FOX
- 841 mots
- 1 média
Fils aîné de Lazare Carnot, « l'Organisateur de la Victoire », Nicolas Léonard Sadi Carnot est un des pionniers de la thermodynamique. Son unique publication, les Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance, ignorée de son temps...
-
CHALEUR
- Écrit par Paul GLANSDORFF
- 985 mots
La première tentative d'interprétation physique assimilait la chaleur à un fluide dit subtil et indestructible dénommé le calorique, répandu partout au sein de la matière. Son passage d'un corps à un autre était notamment responsable du refroidissement du premier et de l'échauffement du second....
-
CLAUSIUS RUDOLF (1822-1888)
- Écrit par Robert FOX
- 1 001 mots
Rudolf Julius Emanuel Clausius, l'un des plus grands physiciens du xixe siècle, est connu principalement pour sa contribution à l'étude de la thermodynamique. Le premier, ce savant allemand formula ce qu'on a coutume d'appeler le deuxième principe et proposa une définition claire de l'...
- Afficher les 39 références